Ressonância (efeito mesomérico)
Ressonância, também conhecida como efeito mesomérico, é um fenômeno físico que ocorre exclusivamente em moléculas insaturadas, ou seja, moléculas que apresentam pelo menos uma ligação dupla ou uma ligação tripla.
Veja também: Fenômenos Físicos e Químicos
Cadeias carbônicas de moléculas insaturadas
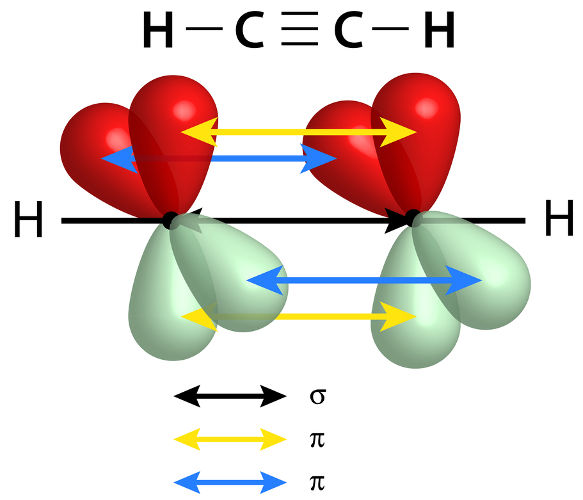
É importante dizer que uma ligação covalente dupla é composta por uma ligação sigma e outra ligação pi. A ligação tripla, por sua vez, é composta por duas ligações pi e uma ligação sigma.
A ressonância é caracterizada pelo deslocamento (movimentação) dos elétrons da ligação pi ao longo da cadeia carbônica. Esse deslocamento é provocado por um determinado grupo funcional ou átomo na cadeia.
Para um melhor entendimento sobre essa movimentação dos elétrons na estrutura, observe o exemplo a seguir:
Fórmula estrutural do 1-flúor-propeno
O flúor é um átomo mais eletronegativo que o carbono, logo, ele apresenta tendência de atrair para perto de si os elétrons da ligação pi. Veja:
Movimentação dos elétrons da ligação pi da estrutura do 1-flúor-propeno
Veja a ordem decrescente de eletronegatividade dos ametais:
Como o flúor é mais eletronegativo (veja o esquema acima), os elétrons da ligação pi são atraídos por ele, logo, o átomo de flúor fica mais negativo, e o carbono, que está mais afastado desses elétrons, mais positivo.
Representação dos polos formados na estrutura do 1-flúor-propeno
Fica evidente que a ressonância promove a criação de polos (positivo e negativo) na estrutura, fator determinante para a ocorrência de reações orgânicas de oxidação, adição e substituição.
Os elétrons durante a ressonância podem ser deslocados para fora ou para dentro da cadeia, o que determina a ocorrência de duas formas de ressonância, as quais serão caracterizadas a seguir.
Ressonância positiva (M+)
Ocorre quando os elétrons da ligação pi são empurrados para o interior da cadeia. Veja o que ocorre na molécula da fenilamina:
Fórmula estrutural da substância fenilamina
Na estrutura do radical fenil entre os átomos de carbono, existem três ligações duplas alternadas, as quais são compostas por uma ligação pi e uma ligação sigma. A alternância entre essas ligações duplas é suficiente para que haja a ocorrência de uma ressonância, ou seja, as ligações pi mudam de posição constantemente.
Representação do fenômeno da ressonância natural no fenil
Agora, é fato que, em um dos carbonos da estrutura, está o grupo amina (NH2), composto por um átomo de nitrogênio que realiza uma ligação sigma com cada um dos dois hidrogênios. Como a diferença de eletronegatividade do nitrogênio é muito maior para o hidrogênio do que para o carbono, o nitrogênio atrai para perto de si os elétrons das ligações sigma com os dois hidrogênios. Assim, o nitrogênio fica carregado negativamente.
Vale dizer que o nitrogênio (por ser mais eletronegativo) também atrairia os elétrons da ligação sigma com o carbono, mas como está carregado negativamente e o carbono possui uma ligação pi, é gerada a ressonância. Com isso, os elétrons da ligação pi são empurrados para longe desse carbono.
Representação do grupo amina empurrando os elétrons em direção à cadeia
Como resultado, o nitrogênio terá carga negativa; o carbono de número 1 estará positivo; o carbono de número dois estará negativo e assim sucessivamente.
Representação dos polos formados na estrutura da fenilamina
Ressonância negativa (M-)
Ocorre quando os elétrons da ligação pi são atraídos para a extremidade da cadeia. Veja o que ocorre na molécula do propenal:
Fórmula estrutural do propenal
No propenal existem duas ligações pi: uma entre carbonos e outra entre um carbono e um dos oxigênios. Como o oxigênio é mais eletronegativo que o carbono, ele atrai os elétrons da ligação pi. Assim, o oxigênio fica negativo, e o carbono, positivo.
Representação da atração de elétrons pelo oxigênio no propenal
Em seguida, como o carbono de número 1 está deficiente em elétrons, imediatamente os elétrons da ligação pi entre os carbonos de número 2 e 3 são deslocadps. Assim, a ligação pi posiciona-se entre os carbonos de número 1 e 2, resultando no deslocamento dos elétrons para a extremidade da cadeia.
Representação dos polos formados na estrutura do propenal
Como resultado, o oxigênio terá carga negativa; o carbono 1 e 2 estarão neutros; e o carbono 3 ficará positivo.