Transformações gasosas
As transformações gasosas são processos termodinâmicos em que pressão, volume ou temperatura de uma amostra se mantém constante; são nomeadas: transformação isobárica; transformação isovolumétrica; transformação isotérmica respectivamente; ou, ainda, transformação adiabática, quando não ocorre troca de calor entre a amostra e a vizinhança.
Leia também: O que é o gás ideal?
Resumo sobre transformações gasosas
- As transformações gasosas submetem uma amostra às variações da pressão, volume ou temperatura, mantendo uma delas constante.
- São elas : transformação isobárica, transformação isotérmica, transformação isovolumétrica e transformação adiabática.
- Na transformação isobárica, a pressão é constante.
- Na transformação isotérmica, a temperatura é constante.
- Na transformação isovolumétrica, o volume é constante.
- Na transformação adiabática, não ocorre troca de calor.
- As leis das transformações gasosas são: lei de Boyle, lei de Gay-Lussca e lei de Charles.
O que são as transformações gasosas?
As transformações gasosas são processos em que pressão, volume ou temperatura de uma amostra se mantém inalterado ao longo do tempo. Elas definem o estado ou comportamento dos gases com base nas grandezas físicas pressão, volume e temperatura, já que, quando alguma dessas grandezas é alterada, esse gás sofre uma transformação gasosa ou mudança de estado físico.
Tipos de transformações gasosas
Existem quatro tipos de transformações gasosas: isobárica, isotérmica, isovolumétrica e adiabática.
→ Transformação isobárica
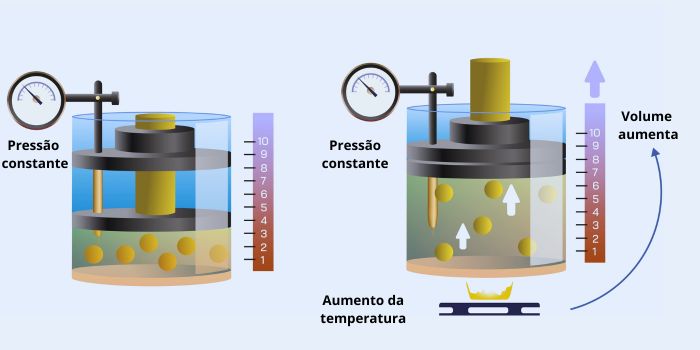
Na transformação isobárica, ocorre a pressão constante, sem variar ao longo do tempo, enquanto o volume e a temperatura da amostra variam de maneira diretamente proporcional. Por exemplo, temos uma transformação isobárica quando um balão está cheio de ar. Saiba mais sobre essa transformação gasosa clicando aqui.
-
Videoaula sobre transformação isobárica
→ Transformação isotérmica
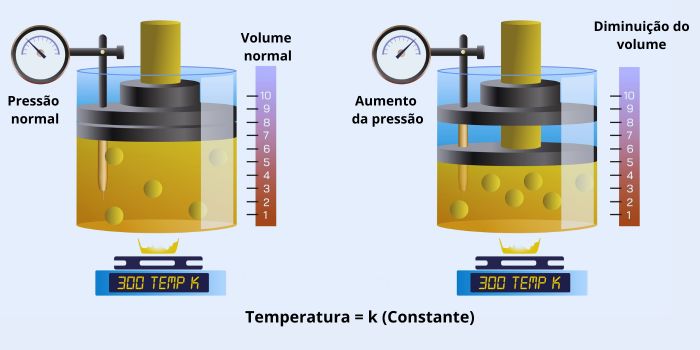
Na transformação isotérmica, ocorre a temperatura constante, sem variar ao longo do tempo, enquanto o volume e a pressão da amostra variam de maneira inversamente proporcional. Por exemplo, temos uma transformação isotérmica quando um gás se expande ou contrai lentamente em temperatura constante. Para saber mais sobre esse tipo de transformação, clique aqui
-
Videoaula sobre transformação isotérmica
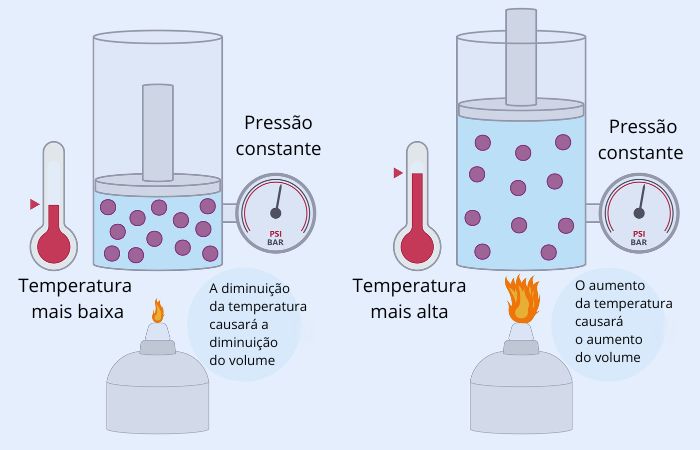
→ Transformação isovolumétrica
Na transformação isovolumétrica, também chamada de isocórica, ocorre o volume constante, sem variar ao longo do tempo, enquanto a pressão e a temperatura da amostra variam de maneira diretamente proporcional. Por exemplo, temos uma transformação isovolumétrica quando ocorre o aquecimento da água em uma panela de pressão.
→ Transformação adiabática
Na transformação adiabática, não ocorrem trocas de calor entre a amostra e a vizinhança ou com seu recipiente. Por exemplo, temos uma transformação adiabática quando liberamos o gás no interior de um spray aerossol. Saiba mais sobre essa transformação clicando aqui.
Leis das transformações gasosas
Existem três leis que regem as transformações gasosas: a lei de Boyle, a lei de Gay-Lussac e a lei de Charles.
→ Lei de Boyle
A lei de Boyle, também conhecida como lei de Boyle-Mariotte, foi desenvolvida no século XVII pelo polímata Robert Boyle (1627-1691) e o cientista e padre Edme Mariotte (1620-1684). Eles observaram que, quando mantinham a temperatura de uma amostra constante — transformação isotérmica —, existia uma relação inversamente proporcional entre a sua pressão e o seu volume, tal que, à medida que aumentava a sua pressão, o seu volume diminuia e vice-versa.
A lei de Boyle é expressa pela fórmula:
\(p_i\cdot V_i=p_f\cdot V_f\)
pi é a pressão inicial, medida em Pascal [Pa].
Vi é o volume inicial, medido em metros cúbicos [m3].
pf é a pressão final, medida em Pascal [Pa].
Vf é o volume final, medido em metros cúbicos [m3].
→ Lei de Gay-Lussac
A lei de Gay-Lussac foi comprovada experimentalmente pelo físico e químico Louis Joseph Gay-Lussac (1778-1850). Ele observou que, quando mantinha a pressão de uma amostra constante — transformação isobárica —, existia uma relação diretamente proporcional entre o seu volume e a sua temperatura, tal que, à medida que aumentava o seu volume, a sua temperatura também aumentava e vice-versa.
A lei de Gay-Lussac é expressa pela fórmula:
\(\frac{V_i}{T_i}=\frac{V_f}{T_f}\)
Vi é o volume inicial, medido em metros cúbicos [m3].
Ti é a temperatura inicial, medida em Kelvin [K].
Vf é o volume final, medido em metros cúbicos [m3].
Tf é a temperatura final, medida em Kelvin [K].
→ Lei de Charles
A lei de Charles foi desenvolvida pelo polímata Jacques Alexandre César Charles (1746-1823). Ele observou que, quando mantinha o volume de uma amostra constante — transformação isovolumétrica —, existia uma relação diretamente proporcional entre a sua pressão e a sua temperatura, tal que, à medida que aumentava a sua pressão, a sua temperatura também aumentava e vice-versa.
A lei de Charles é expressa pela fórmula:
\(\frac{p_i}{T_i}=\frac{p_f}{T_f}\)
pi é a pressão inicial, medida em Pascal [Pa].
Ti é a temperatura inicial, medida em Kelvin [K].
pf é a pressão final, medida em Pascal [Pa].
Tf é a temperatura final, medida em Kelvin [K].
Saiba mais: Como a temperatura influencia o comportamento dos gases
Exercícios resolvidos sobre transformações gasosas
01) Um gás, em um recipiente A, apresenta volume de 50 litros, temperatura de 270 K e pressão de 2 atm. Ele passa por uma transformação isobárica em que seu volume aumenta para 150 litros. Em vista disso, para qual valor foi modificada sua temperatura?
a) 270 K
b) 490 K
c) 650 K
d) 730 K
e) 810 K
Resolução:
Alternativa E
Calcularemos a temperatura final do gás por meio da fórmula que a relaciona à pressão, à temperatura e ao volume:
\(\frac{p_o\cdot V_o}{T_o}=\frac{p\cdot V}{T}\)
Como se trata de uma transformação isobárica, em que a pressão se mantém constante, a fórmula se reconfigura como:
\(\frac{V_o}{T_o}=\frac{V}{T}\)
\(\frac{50}{270}=\frac{150}{T}\)
\(50\cdot T=150\cdot270\)
\(50\cdot T=40500\)
\(T=\frac{40500}{50}\)
\(T=810\ K\)
02) (UFAM-AM) Analise as seguintes afirmativas a respeito dos tipos de transformações ou mudanças de estado de um gás.
I – Em uma transformação isocórica, o volume do gás permanece constante.
II – Em uma transformação isobárica, a pressão do gás permanece constante.
III – Em uma transformação isotérmica, a temperatura do gás permanece constante.
IV – Em uma transformação adiabática, variam o volume, a pressão e a temperatura.
Com a relação às quatro afirmativas acima, podemos dizer que:
a) só I e III são verdadeiras.
b) só II e III são verdadeiras.
c) I, II, III e IV são verdadeiras.
d) só I é verdadeira.
e) todas são falsas.
Resolução:
Alternativa C
Todas as alternativas estão corretas, abordando suas definições corretamente.
Fontes
HALLIDAY, David; RESNICK, Robert; WALKER, Jearl. Fundamentos da Física: Gravitação, Ondas e Termodinâmica (vol. 2). 10. ed. Rio de Janeiro, RJ: LTC, 2016.
NUSSENZVEIG, Herch Moysés. Curso de física básica: Fluidos, Oscilações e Ondas, Calor (vol. 2). Editora Blucher, 2015.


