Temperatura como variável de estado dos gases

A temperatura é definida como a medida do nível de energia térmica de um material, ou seja, é a medida do nível ou grau de agitação das partículas constituintes (átomos ou moléculas). Quanto mais agitadas estiverem essas partículas, maior será o valor da temperatura.
Assim como a massa e o volume, que podem ser medidos com o auxílio de alguns equipamentos, como balanças e vidrarias graduadas, a temperatura também é uma grandeza e pode ser medida por meio de um termômetro digital ou de mercúrio. O termômetro de mercúrio é feito de um fino tubo de vidro com mercúrio dentro. Esse líquido dilata-se com o aumento da temperatura e assim indica seu valor na graduação, que fica na parte externa do tubo.
Essas graduações são chamadas de escalas termométricas e são três as mais utilizadas: graus Celsius (ºC), Kelvin (K) e Fahrenheit (ºF). Veja como converter essas unidades umas nas outras no texto Conversão de Escalas Termométricas.
No caso do estudo da temperatura dos gases ideais, considera-se somente a escala Kelvin, que também é chamada de zero absoluto ou zero termodinâmico. Isso porque a escala Kelvin não possui valores negativos para a temperatura como ocorre com a escala Celsius. O zero absoluto, que corresponde à temperatura de -273,15 ºC, nunca foi atingido. Acredita-se que, nesse ponto, a agitação das partículas para completamente, estando todas as substâncias no estado sólido, e que, no caso dos metais, eles tornam-se supercondutores, ou seja, a resistência elétrica deles é igual a zero.
A temperatura é considerada uma propriedade intensiva porque não depende da massa da amostra. Se você medir a temperatura de uma panela cheia de água, por exemplo, e, depois, retirar um copo dessa água e medir novamente, a temperatura será a mesma. Essa é uma das propriedades que diferenciam o calor da temperatura, pois o calor depende da massa do material. Ele, na verdade, é a energia térmica em trânsito, isto é, quando essa energia flui de modo espontâneo de um corpo de maior temperatura para um de menor temperatura. Assim, quanto maior for a massa do material de maior temperatura, maior será o calor fornecido.
A temperatura também é uma das variáveis de estado dos gases, assim como a pressão e o volume. A variação dessas três grandezas exerce grande influência sobre as propriedades e comportamento das substâncias gasosas. Só faz sentido mencionarmos o volume do gás, por exemplo, se fornecermos também a sua pressão e temperatura.
Quando a pressão é mantida constante (Transformação isobárica), a temperatura varia proporcionalmente com a variação do volume. Isso ocorre porque, se a temperatura aumenta, significa que a agitação das partículas constituintes do gás está maior. Com isso, a tendência é haver a expansão do gás, isto é, o volume aumenta com o aumento da temperatura.
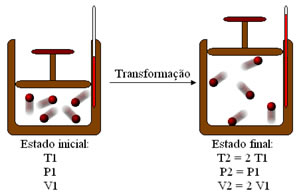
A transformação isobárica acima mostra que, quando a temperatura aumenta o dobro do inicial, o volume também dobra
Agora quando o volume é mantido constante (Transformação isocórica ou isovolumétrica), a temperatura varia proporcionalmente com a variação da pressão. Isso quer dizer que, se aumentarmos a temperatura, a pressão dentro do recipiente que contém o gás também aumentará e vice-versa. Isso ocorre porque a pressão é resultado das colisões das partículas do gás com as paredes do recipiente, assim, quanto mais colisões, maior será a pressão. Se a temperatura aumentar, a energia cinética das partículas também aumentará, e elas se movimentarão com maior velocidade, aumentando a pressão.
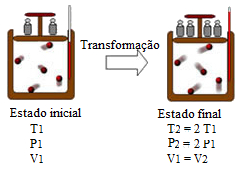
A transformação isocórica acima mostra que, quando a pressão dobra, a temperatura também tem seu valor dobrado
Ferramentas Brasil Escola
Artigos Relacionados

Últimas notícias
Outras matérias


















