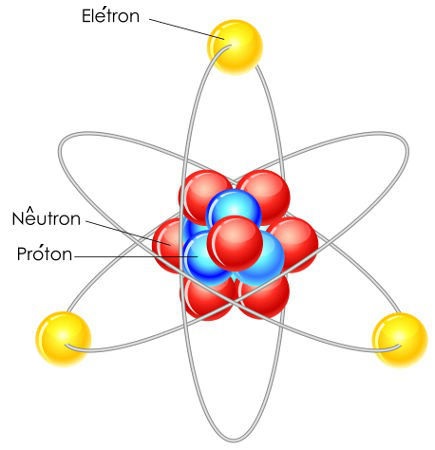
Cálculo das partículas atômicas
A estrutura de um átomo é composta basicamente por núcleo, níveis, subníveis, orbitais e partículas atômicas. As partículas atômicas são os prótons, nêutrons e elétrons. Os prótons e nêutrons estão localizados no interior do núcleo, e os elétrons, nos orbitais.
Para realizar o cálculo das partículas atômicas, é fundamental que conheçamos algumas características do átomo:
É representado pela letra Z, sempre maiúscula, e indica:
-
A quantidade de prótons (p) no interior do núcleo;
-
A quantidade de elétrons (e) no interior dos orbitais.
Não pare agora... Tem mais depois da publicidade ;)
Assim, o número atômico é igual ao número de prótons e elétrons:
Z = p = e
O número atômico é posicionado sempre à esquerda, subscrito, na sigla do átomo do elemento químico, como na representação abaixo:
ZX
É representado pela letra A, sempre maiúscula, e indica a soma do número de prótons (p) com o número de nêutrons (n) presentes no núcleo do átomo:
A = p + n
O número de massa é posicionado sempre à esquerda ou à direita, sobrescrito, na sigla do átomo do elemento químico, como na representação abaixo:
AX ou XA
Agora veja alguns exemplos:
c) Exemplos de cálculo do número de partículas
1º Exemplo: Cálculo das partículas do átomo Sódio (11Na23)
-
Número atômico (subscrito à esquerda): 11
Como o número atômico é 11, logo, temos no átomo de Sódio:
-
11 prótons
-
11 elétrons
Para finalizar, basta determinar o número de nêutrons, já que conhecemos o número de prótons (11) e o número de massa (sobrescrito à direita, 23). Para isso, utilize a fórmula abaixo:
A = p + n
23 = 11 + n
23 – 11 = n
N = 12
2º Exemplo: Cálculo das partículas do átomo Estanho (50Sn119)
-
Número atômico (subscrito à esquerda): 50
Como o número atômico é 50, logo, temos no átomo de Estanho:
-
50 prótons
-
50 elétrons
Para finalizar, basta determinar o número de nêutrons, já que conhecemos o número de prótons (50) e o número de massa (sobrescrito à direita, 119). Para isso, utilize a fórmula abaixo:
A = p + n
119 = 50 + n
119 – 50 = n
N = 69
Exemplo 3: Cálculo das partículas do átomo de Urânio (92U238)
-
Número atômico (subscrito à esquerda): 92
Como o número atômico é 92, logo, temos no átomo de Urânio:
-
92 prótons
-
92 elétrons
Para finalizar, basta determinar o número de nêutrons, já que conhecemos o número de prótons (92) e o número de massa (sobrescrito à direita, 238). Para isso, utilize a fórmula abaixo:
A = p + n
238 = 92 + n
238 – 92 = n
N = 146