Modelo atômico de Rutherford
O modelo atômico de Rutherford é assim chamado devido ao seu desenvolvedor, Ernest Rutherford, o qual em 1909, com a participação de outros dois cientistas, Hans Geiger e Ernest Marsden, realizou um experimento que ficou conhecido como “espalhamento de partículas alfa”. Esse experimento foi crucial para a compreensão da estrutura atômica e levou Rutherford à formulação do modelo nuclear do átomo. Nesse sentido, a proposta dele revelou a existência do núcleo atômico e influenciou profundamente o desenvolvimento da Física moderna.
Leia também: Número atômico — o que é, para que serve e como identificar
Resumo sobre modelo atômico de Rutherford
- O modelo atômico de Rutherford foi proposto por Ernest Rutherford em 1911.
- Ele descreve o átomo como um núcleo central pequeno e denso.
- O núcleo é composto por prótons e nêutrons.
- Elétrons orbitam ao redor do núcleo em órbitas definidas.
- O modelo atômico de Rutherford é comparado a um sistema solar em miniatura.
- É baseado no experimento de espalhamento de partículas alfa.
- Revelou a estrutura interna do átomo.
- Contribuiu para o desenvolvimento de modelos atômicos posteriores.
- Outros modelos atômicos são: modelo atômico de Dalton (bola de bilhar), modelo atômico de Thomson (pudim de passas), modelo atômico de Bohr, modelo atômico de Schrödinger (quântico).
Videoaula sobre modelo atômico de Rutherford
O que diz a teoria atômica de Rutherford?
Rutherford propôs que o átomo possui uma estrutura semelhante a um sistema solar em miniatura, isto é, com um núcleo central positivamente carregado e elétrons orbitando ao redor dele, assim como os planetas ao redor do sol. Sendo assim, esse modelo descreve que o núcleo é a parte central e mais densa do átomo, onde reside a maior parte de sua massa e toda a carga positiva.
Experimento de Rutherford
Para chegar a essa teoria, Rutherford conduziu o famoso experimento em que bombardeou uma fina folha de ouro com partículas alfa (α). Para isso, o experimento foi realizado em uma câmara de vácuo contendo uma fonte de partículas alfa, que são núcleos de hélio com carga positiva, emitidas por um material radioativo (como o polônio). Ao mesmo tempo, uma fina folha de ouro foi colocada no centro da câmara.
Diante disso, ele observou que a maioria das partículas alfa passava diretamente pela folha, mas algumas eram desviadas em grandes ângulos ou até mesmo refletidas de volta, conforme pode ser visto na imagem a seguir:
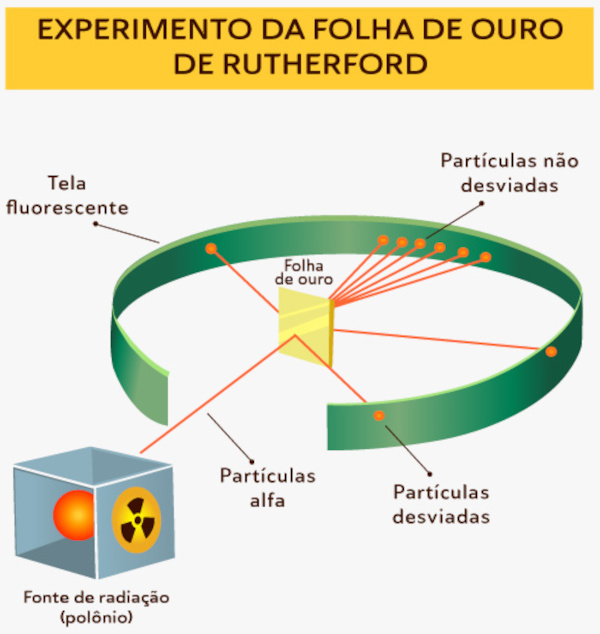
Portanto, Rutherford concluiu que o átomo possui um núcleo central muito pequeno e denso e que a maior parte do átomo é composta por espaço vazio, com os elétrons ocupando uma região relativamente grande em comparação com o tamanho do núcleo.
→ Qual foi o objetivo do experimento de Rutherford?
O objetivo do experimento era investigar a estrutura interna do átomo, especialmente a distribuição da carga positiva. Sendo assim, com base no modelo atômico aceito na época, o "modelo do pudim de passas" de Thomson, esperava-se que as partículas alfa passassem sem desviar significativamente ao atravessar a folha de ouro, uma vez que a carga positiva seria uniformemente distribuída.
Veja também: O que diz a teoria atômica de Dalton?
Características do modelo atômico de Rutherford
O modelo atômico de Rutherford apresenta algumas características bem distintas dos demais modelos antecessores. Nesse contexto, podemos destacar:
- a existência de um núcleo;
- espaços vazios em torno do núcleo;
- a ideia de um modelo planetário.
Conforme pode ser visualizado a seguir:
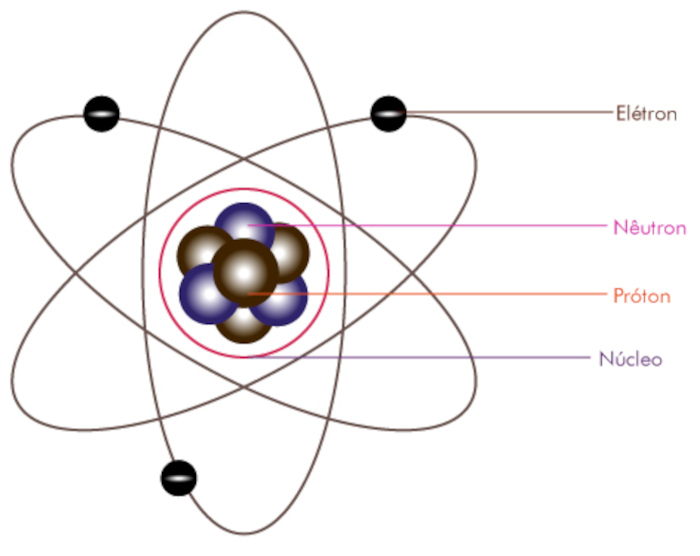
Diante disso, vamos entender um pouco sobre cada uma dessas características:
- Núcleo: o átomo é composto por um núcleo extremamente pequeno e denso, onde se concentra quase toda a massa do átomo e toda a carga positiva, ou seja, é onde ficam localizados os prótons e nêutrons.
- Espaço vazio: a maior parte do átomo é um espaço vazio, com os elétrons orbitando ao redor do núcleo em órbitas definidas. Em outras palavras, esse espaço representa a maior parte do volume total do átomo.
- Modelo planetário: o modelo de Rutherford compara a estrutura do átomo a um sistema solar, com os elétrons orbitando o núcleo central semelhante aos planetas orbitando ao redor do sol.
Falhas no modelo atômico de Rutherford
Embora o modelo atômico de Rutherford tenha sido um avanço significativo na compreensão da estrutura atômica, ele apresentava algumas falhas que foram posteriormente corrigidas por modelos mais refinados. Sendo assim, podemos destacar:
- Estabilidade dos elétrons em órbita: pois de acordo com as leis da eletrodinâmica clássica, os elétrons em órbita ao redor do núcleo emitiriam energia continuamente, perdendo velocidade e caindo em espiral em direção ao núcleo.
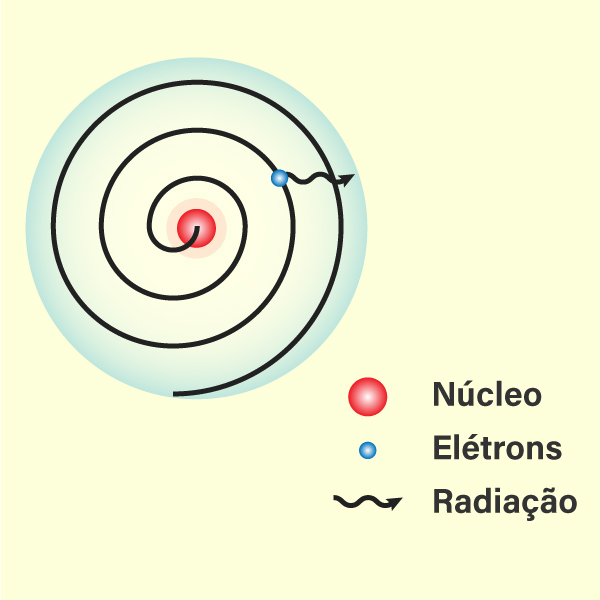
- Estrutura espectral do hidrogênio: o modelo de Rutherford não conseguia explicar adequadamente a estrutura espectral do hidrogênio, especialmente as linhas espectrais finas observadas no espectro do hidrogênio.
- Distribuição da carga positiva: esse modelo implicava que a carga positiva do átomo estava concentrada em um pequeno núcleo central, o que não explicava como os elétrons podiam permanecer em órbita ao redor do núcleo sem serem atraídos para ele devido à força eletrostática.
Diante disso, para corrigir essas falhas, o modelo atômico de Rutherford foi posteriormente aprimorado pelo modelo de Bohr, que introduziu órbitas quantizadas para os elétrons e postulou que os elétrons só podiam ocupar certas órbitas ao redor do núcleo, evitando assim a emissão contínua de energia e garantindo a estabilidade do átomo.
Qual é a importância do modelo atômico de Rutherford?
O modelo atômico de Rutherford teve grande importância para o desenvolvimento de modelos atômicos mais refinados, como o modelo de Bohr e o modelo atual baseado na mecânica quântica. Em vista disso, esses modelos subsequentes incorporaram as descobertas e correções necessárias para explicar fenômenos que o modelo de Rutherford não conseguia explicar, como a estabilidade dos elétrons em órbita.
Portanto, esse modelo foi um dos primeiros passos para a compreensão da Física Nuclear e da estrutura dos núcleos atômicos, abrindo caminho para estudos mais aprofundados sobre a composição dos átomos, bem como para o desenvolvimento de aplicações práticas, como a energia nuclear.
Saiba mais: Como os elétrons se organizam em torno do núcleo atômico
Outros modelos atômicos
Além do modelo atômico de Rutherford, vários outros modelos foram propostos ao longo do tempo para descrever a estrutura do átomo, sendo eles:
- Modelo de Dalton: segundo Dalton, os átomos são as unidades básicas e fundamentais da matéria e não podem ser divididos em partes menores durante uma reação química. Além disso, ele postulou que todos os átomos de determinado elemento são idênticos em massa, tamanho e outras propriedades.
- Modelo de Thomson (pudim de passas): proposto por J.J. Thomson em 1904, esse modelo descrevia o átomo como uma esfera de carga positiva com elétrons dispersos uniformemente dentro dela, semelhante a um pudim de passas.
- Modelo de Bohr: proposto por Niels Bohr em 1913, esse modelo introduziu a ideia de órbitas quantizadas para os elétrons ao redor do núcleo. Ele postulou que os elétrons só podiam ocupar certas órbitas estáveis, explicando assim as linhas espectrais finas do hidrogênio.
- Modelo atômico atual (Schrödinger): desenvolvido na década de 1920 por vários cientistas, incluindo Werner Heisenberg e Erwin Schrödinger, esse modelo descreve o átomo em termos de equações matemáticas da mecânica quântica, em que o átomo como possui um núcleo (prótons e nêutrons) e os elétrons são como ondas de probabilidade ao redor do núcleo, em vez de partículas em órbita definida. Ou seja, incorpora os princípios da Física Quântica para descrever a estrutura atômica com precisão.
Por fim, veja abaixo a representação gráfica de cada um desses modelos:
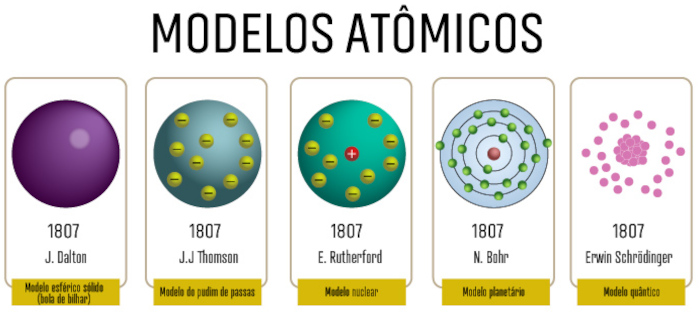
Exercícios resolvidos sobre o modelo atômico de Rutherford
1) (Fundatec – IFSC) Os modelos atômicos foram apresentados por cientistas na tentativa de compreender melhor o átomo e a sua composição. Nesse sentido, analise as assertivas abaixo:
I. De acordo com a teoria atômica de Dalton, os átomos são permanentes e indivisíveis, eles não podem ser criados nem destruídos.
II. Thomson propôs que o átomo é constituído de uma esfera positiva grande e difusa, na qual os elétrons eram encaixados.
III. Bohr usou o tubo de raios catódicos e seu conhecimento da teoria eletromagnética para determinar a razão entre a carga elétrica e a massa de um elétron.
IV. O modelo atômico de Rutherford representa o átomo consistindo em um pequeno núcleo, que contém toda a carga positiva e quase toda a massa do átomo, rodeado pelos elétrons.
Quais estão INCORRETAS?
a) Apenas I.
b) Apenas III.
c) Apenas I e II.
d) Apenas III e IV.
e) Apenas I, II e III.
Gabarito: b
O experimento do tubo de raios catódicos foi realizado por Thomson e não por Bohr.
2) (FGV - SME) “Em 1909, o físico neozelandês Ernest Rutherford e dois auxiliares, o inglês Ernest Marsden e o alemão Hans Geiger, bombardearam folhas de ouro finíssimas com partículas de carga positiva emitidas por uma fonte radioativa. O resultado causou profunda estranheza. Parte dessas partículas – denominadas radiação alfa – ricocheteavam bruscamente ao atingir a lâmina do metal. Dois anos depois, Rutherford, em letras trêmulas, escreveu sua conclusão.”
(ANJOS, J.C. e VIEIRA, C.L. Um olhar para o futuro – Desafios da física para o século 21. Rio de Janeiro: Vieira & Lent: FAPERJ, 2008.)
A partir desse experimento, Rutherford concluiu que
a) A menor parte da massa do átomo estava na região central – o núcleo –, formado por partículas chamadas prótons e nêutrons.
b) Átomo, eletricamente neutro, era formado por elétrons mergulhados em uma esfera com carga positiva.
c) A maior parte da massa do átomo estava na região central – o núcleo –, formado por partículas positivas chamadas prótons.
d) O átomo, eletricamente neutro, era formado por elétrons mergulhados em uma esfera com carga negativa.
e) Os átomos eram como pequenas esferas indivisíveis, indestrutíveis e maciças.
Gabarito: a
Nesse experimento, Rutherford descobriu que o átomo tinha partículas positivas e neutras concentradas na região central do átomo.
Fontes
CARUSO, F.; OGURI, V. A Eterna Busca do Indivisível: do Átomo Filosófico aos Quarks e Léptons. Química Nova, v. 20, n. 3, p. 324–334, 1997.
CUÉLLAR, L.; GALLEGO BADILLO, R.; PÉREZ MIRANDA, R. El modelo atómico de E. Rutherford del saber científi co al conocimiento escolar. Enseñanza de las Ciencias. Revista de investigación y experiencias didácticas, v. 26, n. 1, p. 43–52, 2008.
LOPES, B. E. R.; GOMES, B. M. Dos filósofos gregos à Bohr: uma revisão histórica sobre a evolução dos modelos atômicos. Revista Ifes Ciência, v. 4, n. 2, p. 122–139, 2018.
MARQUES, D. M. As investigações de Ernest Rutherford sobre a estrutura da matéria: contribuições para o ensino de Química. [s.l: s.n.].
URIBE BELTRÁN, M. V.; CUÉLLAR FERNÁNDEZ, L. Estudio Histórico-Epistemológico del modelo atómico de Rutherford. TED: Tecné, Episteme y Didaxis, n. 14, 11 jul. 2017.


