Cálculos que envolvem semelhança atômica
Cálculos envolvendo semelhança atômica são muito explorados nos processos seletivos (vestibulares e Enem) e requerem informações específicas de um átomo, a saber:
-
número atômico (Z): indica o número de prótons e elétrons de um átomo neutro;
-
número de massa (A): é a resultante da soma do número de prótons e elétrons;
-
número de elétrons (e);
-
número de prótons (p);
-
número de nêutrons (n).
Não pare agora... Tem mais depois da publicidade ;)
O cálculo envolvendo a semelhança atômica pode determinar também a quantidade de partículas (elétrons) necessária para a realização da distribuição eletrônica de um átomo ou de um íon ou para determinar o conjunto de números quânticos de um elétron específico do átomo.
É fundamental que o estudante saiba os tipos e as características de cada um dos tipos de semelhança existentes para ter condições de realizar os cálculos que envolvem esses assuntos.
Tipos de semelhança atômica
a) Isótopos
São átomos que apresentam o mesmo número atômico, ou seja, mesmo número de prótons, e diferentes números de massa.
![]()
Exemplos de átomos isótopos
b) Isóbaros
São átomos que apresentam o mesmo número de massa e diferentes números atômicos.
![]()
Exemplos de átomos isóbaros
c) Isótopos
São átomos que apresentam diferentes números de massa e números atômicos, mas o mesmo número de nêutrons.
![]()
Exemplos de átomos isótonos
d) Isoeletrônicos
São átomos que apresentam o mesmo número de elétrons.
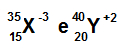
Exemplos de átomos isoeletrônicos
Exemplos de cálculos que envolvem semelhança atômica
Exemplo 1: Considere os elementos 54A140, B e C, de números atômicos consecutivos, na ordem dada. Sabendo que A e B são isóbaros e que B e C são isótonos, determine o número de nêutrons do elemento B e o número de massa do elemento C.
Resolução:
O exercício fornece os seguintes dados:
- Átomo A
-
número de massa (A) = 140;
-
número atômico (Z) = 54;
-
n = 86, encontrado pela subtração da massa (140) pelo número de prótons (55);
-
e = 54, pois o átomo é neutro (p = e);
-
p = 54, pois é igual a Z.
- Átomo B
-
número de massa (A) = 140, pois é isóbaro de A;
-
número atômico (Z) = 55, pois o enunciado diz que os átomos possuem números atômicos consecutivos, assim se A vale 54, B vale 55.
-
n = 85, encontrado através da subtração da massa (140) pelo número de prótons (55).
- Átomo C
-
número atômico (Z) = 56, pois o enunciado diz que os átomos possuem números atômicos consecutivos; assim, se B vale 55, C vale 56;
-
n = 86, pois o enunciado diz que os átomos A e C são isótonos;
-
A = 142, encontrado pela soma entre o número de prótons (56) e o número de nêutrons.
Assim temos que o átomo B apresenta 85 nêutrons e o átomo C apresenta número de massa igual a 142.
Exemplo 2: Dois átomos (A e B) são isóbaros. O átomo A tem número de massa igual a 4x + 5 e número atômico igual a 4x + 3. B tem número de massa igual a 6x – 3. Qual é o número atômico, número de massa, número de nêutrons e número de elétrons do átomo A?
Resolução:
O exercício fornece os seguintes dados:
- Átomo A
-
número de massa (A) = 4x + 5;
-
número atômico (Z) = 2x +3;
-
Z = ?
-
A = ?
-
n = ?
-
e = ?
-
p =?
- Átomo B
-
número de massa = 6x – 3.
Para determinar os valores que ele requer sobre o átomo A, é necessário encontrar o valor da incógnita x.
→ Encontrando o valor de x
Para encontrar o valor de x, vamos igualar a massa do átomo A com a massa do átomo B, já que eles são isóbaros (de mesma massa), como representado a seguir:
4x + 5 = 6x - 3
6x - 4x = 5 + 3
2x = 8
x = 8
2
x = 4
Com o valor de x, basta utilizá-lo nas expressões fornecidas para o átomo A e encontrar as partículas requeridas:
→ Calculando o número atômico
Z = 2x +3
Z = 2.(4) +3
Z = 8 + 3
Z = 11
Vale ressaltar que o número atômico de um átomo é sempre igual ao número de prótons, logo, o átomo A apresenta 11 prótons (p). Além disso, como se trata de um átomo neutro, o número de elétrons também é igual a 11 (e).
→ Calculando o número de massa
A = 4x + 5
A = 4 .(4) + 5
A = 16 + 5
A = 21
→ Calculando o número de nêutrons
Como temos o número de prótons e o número de massa, para calcular o número de nêutrons, basta utilizar a expressão padrão para o número de massa:
A = p + n
21 = 11 + n
21 – 11 = n
n = 10
Exemplo 3: O número de elétrons do cátion X2+ é igual ao número de prótons do átomo Y, que, por sua vez, é isótopo do átomo W, que apresenta número atômico e número de massa, respectivamente, iguais a 26 e 64. Qual é o número atômico do elemento X?
Resolução:
O exercício fornece os seguintes dados:
- Átomo W
-
número de massa (A) = 64;
-
número atômico (Z) = 26;
-
n = 38, encontrado pela subtração da massa (64) pelo número de prótons (26);
-
e = 26, pois o átomo é neutro (p = e);
-
p = 26, pois é igual a Z.
- Átomo Y
-
número de massa (A) = 140, pois é isóbaro de A;
-
número atômico (Z) = 26, pois o enunciado diz que os átomos Y e W são isótopos (mesmo número de prótons);
-
número de elétrons = 26, pois o átomo é neutro (p = e).
- Átomo X2+ (a carga 2+ indica que o átomo apresenta dois elétrons a menos em relação ao número de prótons)
-
número de elétrons = 26, pois o exercício disse que seu número de elétrons é igual ao número de prótons do átomo Y;
-
Para determinar o número de prótons e o número atômico do átomo X, basta somar o seu número de elétrons com a carga +2 que foi fornecida:
p ou Z = e + 2
p ou Z = 26 + 2
p ou Z = 28