Pilha de Daniell
A pilha de Daniell é um dispositivo que converte energia de reações químicas em energia elétrica. O funcionamento da pilha de Daniell se baseia em reações de oxirredução, que ocorrem mediante a transferência de elétrons entre duas espécies. O fluxo de elétrons gerado nas reações de oxidação e redução origina a corrente elétrica, que pode ser aproveitada para a geração de energia.
A montagem da pilha de Daniell envolve um eletrodo de zinco, imerso em uma solução de sulfato de zinco. Em outro compartimento, um eletrodo de cobre está imerso em solução de sulfato de cobre. Os dois compartimentos se interconectam por uma ponte salina, e os eletrodos metálicos são conectados por um fio condutor externo. O eletrodo de zinco sofre oxidação, fornecendo elétrons que ocasionam a redução de íons cobre da solução sobre o eletrodo de cobre.
Leia também: Eletrólise — sistema eletroquímico que tem funcionamento oposto ao da pilha
Resumo sobre a pilha de Daniell
- A pilha de Daniell converte energia química em energia elétrica, por meio de reações de oxirredução.
- A pilha de Daniell é formada por eletrodos de cobre e zinco imersos em soluções aquosas dos respectivos íons.
- Os eletrodos se conectam por um circuito externo.
- Os compartimentos se interconectam por meio de uma ponte salina.
- O eletrodo de zinco oxida fornecendo elétrons que causam a redução dos íons cobre.
- O fluxo de elétrons gera corrente elétrica, que é empregada para a geração de energia.
- O potencial-padrão da pilha de Daniell é de 1,10 V.
- A pilha de Daniell é uma evolução da pilha de Volta.
O que é pilha de Daniell?
A pilha de Daniell é um dispositivo capaz de gerar energia elétrica por meio de uma reação química que ocorre mediante a transferência de elétrons (reações de oxirredução) entre espécies químicas.
Essa pilha é formada por duas placas metálicas (eletrodos) imersas em soluções aquosas dos respectivos íons. Trata-se de uma placa de zinco imersa em uma solução de íons zinco e uma placa de cobre imersa em solução de íons cobre. Os eletrodos são interligados por um circuito externo, e os frascos contendo as soluções se interligam por meio de uma ponte salina.
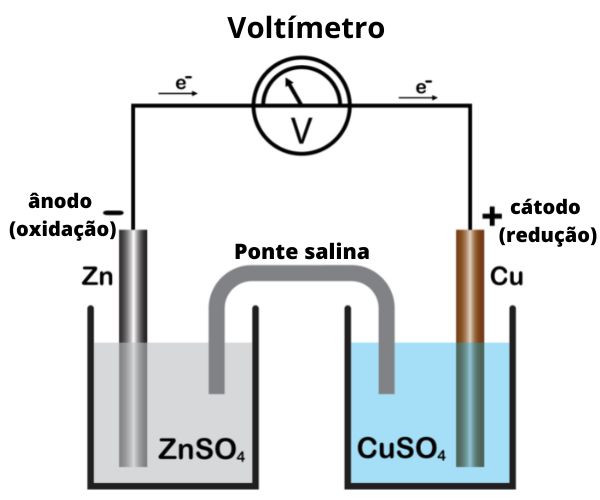
A pilha de Daniell gera energia elétrica por meio da formação de um fluxo ordenado de elétrons que parte do ânodo (eletrodo negativo), a partir da reação de oxidação do zinco metálico, e flui até o cátodo (eletrodo positivo), promovendo a reação de redução dos íons cobre.
Experimento da pilha de Daniell
A pilha de Daniell foi desenvolvida por John Frederic Daniell, em 1836, e é um aprimoramento da pilha de Volta. A sua principal característica é possuir dois compartimentos separados, conhecidos como semicelas, que comportam as placas metálicas imersas nas respectivas soluções aquosas.
O eletrodo de zinco fica imerso em uma solução aquosa de sulfato de zinco (ZnSO4) em um dos compartimentos. No outro, encontra-se o eletrodo de cobre, imerso em uma solução de sulfato de cobre (CuSO4).
Os dois eletrodos são conectados por um fio condutor metálico, que permite a passagem de elétrons e a criação de uma corrente elétrica. É dessa forma que a energia gerada pela reação química é convertida em energia elétrica e pode ser utilizada para diversas aplicações. Nesse experimento, Daniell usou a energia para o acendimento de uma lâmpada.
Os compartimentos se interconectam por meio de uma ponte salina, imersa em ambas as soluções, a qual permite a passagem de íons. A importância da ponte salina é equilibrar a quantidade de íons positivos nos dois compartimentos, evitando que a reação química seja interrompida precocemente.
No decorrer do experimento, Daniell percebeu que aconteciam modificações no sistema. O eletrodo de cobre tinha sua massa aumentada, enquanto o eletrodo de zinco sofria um processo corrosivo com diminuição de massa. O cientista também notou que a coloração da solução de sulfato de cobre passava por um descoloramento, tornando-se azul-clara. Essas observações ajudaram Daniell na interpretação do funcionamento do sistema químico, conforme explicado na sequência.
Como funciona a pilha de Daniell?
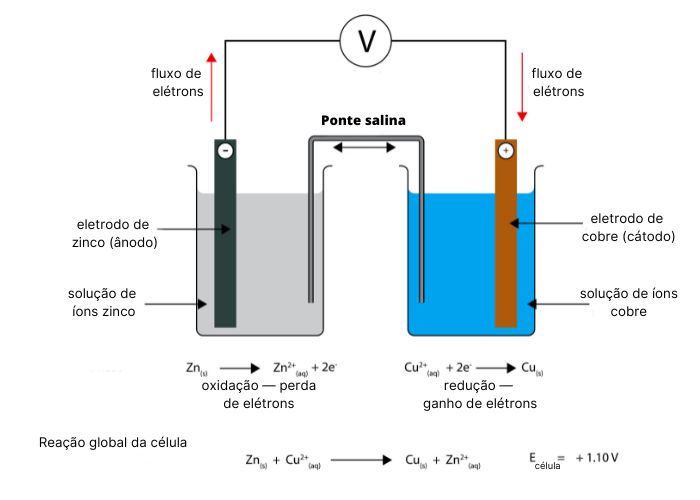
A pilha de Daniell gera eletricidade por meio da reação química de oxirredução entre o zinco metálico e os íons cobre. A reação química que ocorre na pilha pode ser didaticamente representada como duas reações parciais (ou semirreações).
O zinco metálico é mais reativo do que o cobre metálico. Isso significa que a placa de zinco será oxidada com maior facilidade do que a placa de cobre. Nesse processo de oxidação, o zinco metálico perde elétrons, convertendo-se em íons Zn2+ que são liberados para a solução aquosa de sulfato de zinco. Esse processo químico é representado pela seguinte semirreação de oxidação:
\(Zn\ \left(s\right)\longrightarrow\ {Zn}^{2+}\ \left(aq\right)+2\ e^-\)
Tal processo de oxidação resulta em perda de massa do eletrodo de zinco, elevando a concentração de íons Zn2+ em solução.
Os elétrons perdidos pelo eletrodo de zinco são transportados pelo circuito externo e chegam até o eletrodo de cobre, que está em contato com a solução de sulfato de cobre. Os íons Cu2+ da solução recebem os elétrons e sofrem o processo de redução, transformando-se em cobre metálico. Esse processo químico é representado pela seguinte semirreação de redução:
\(\ {Cu}^{2+}\ \left(aq\right)+2\ e^-\ \longrightarrow\ Cu\ \left(s\right)\)
Como o cobre metálico é sólido, acontece a sua deposição sobre o eletrodo de cobre, resultando no aumento de massa desse eletrodo e consequente redução da concentração de Cu2+ na solução.
A solução aquosa de CuSO4 é azul, e a ocorrência da semirreação de redução do cobre pode ser evidenciada pela diminuição da intensidade da coloração da solução.
Portanto, no eletrodo de zinco acontece a semirreação de oxidação, e este é o eletrodo negativo da pilha, conhecido como ânodo. No eletrodo de cobre acontece a semirreação de redução, sendo o eletrodo positivo, ou cátodo.
A reação química global que representa o processo químico que acontece na célula de Daniell é representado por:
\(Zn\ \left(s\right)+\ {Cu}^{2+}\ \left(aq\right)\longrightarrow{Zn}^{2+}\ \left(aq\right)+\ Cu\ \left(s\right)\)
Pilhas podem ser representadas por uma notação simplificada, que indica os elementos envolvidos e sua função no sistema. Nessa notação, utiliza-se uma barra (/) para indicar a interface eletrodo-solução. O símbolo de duas barras (//) representa a ponte salina. À esquerda, é indicado o ânodo (eletrodo em que ocorre a oxidação), e à direita, é representado o cátodo (eletrodo que sofre redução). Para a pilha de Daniell, a notação simplificada é:
Zn(s) / Zn2+(aq) // Cu2+(aq) / Cu(s)
A imagem abaixo detalha os componentes da célula de Daniell, bem como as semirreações e a reação global.
Como calcular a diferença de potencial da pilha de Daniell?
A quantidade de energia que uma pilha é capaz de gerar depende de alguns fatores, como a temperatura, concentração e composição química.
Cada elemento possui uma tendência específica para doar ou receber elétrons que é determinada em relação ao elemento hidrogênio, usado como referência e que possui valor igual a 0 V.
Dessa forma, foi determinada experimentalmente a energia liberada ou requerida por um elemento químico nos processos de doação ou recebimento de elétrons. Esses valores, sob a forma de potencial elétrico, são reunidos em uma tabela de potenciais padrão de redução e são empregados na determinação da energia liberada por uma pilha.
Potenciais padrão de redução a 25 °C
|
Semirreação |
Potencial padrão de redução / V |
|
\({Cl}_2\ \left(g\right)+\ 2e^-\ \longrightarrow\ 2{Cl}^-\ \left(aq\right)\) |
+1,36 |
|
\({Cu}^{2+}\ \left(aq\right)+\ 2e^-\ \longrightarrow\ Cu\ \left(s\right)\) |
+0,34 |
|
\({Pb}^{2+}\ \left(aq\right)+\ 2e^-\ \longrightarrow\ Pb\ \left(s\right)\) |
-0,13 |
|
\({2H}^+\ \left(aq\right)+\ 2e^-\ \longrightarrow\ H_2\ \left(g\right)\) |
0,0 |
|
\({Zn}^{2+}\ \left(aq\right)+\ {2e}^-\ \longrightarrow\ Zn\ \left(s\right)\) |
-0,76 |
|
\({Li}^+\ \left(aq\right)+\ e^-\ \longrightarrow\ Li\ \left(s\right)\) |
-3,05 |
Para a determinação da diferença de potencial (ΔE) em uma pilha, utiliza-se a relação:
\(∆E= E°_{cátodo}- E°_{ânodo}\)
Para a pilha de Daniell, identifique na tabela acima que o potencial associado à redução do cobre é igual a +0,34V e o potencial da redução do zinco é -0,76V. Sabe-se que na pilha de Daniell o cobre é o cátodo e o zinco é o ânodo, logo:
\(∆E= 0,34 V-(-0,76 V)\)
\(∆E= +1,10 V\)
Diferença entre pilha de Daniell e pilha de Volta
A pilha de Volta foi o primeiro sistema químico que utilizou a energia química, fornecida por reações químicas, para a geração de energia elétrica. Foi desenvolvida por Alessandro Giuseppe Volta, em 1800.
A pilha de Volta era construída pelo empilhamento de discos de zinco e prata, separados por discos embebidos em ácido sulfúrico, com um fio condutor unido às extremidades e formando o circuito elétrico fechado, permitindo o fluxo de elétrons e a geração de energia. A limitação desse dispositivo era a rápida descarga, não sendo capaz de armazenar energia por muito tempo. Além disso, por utilizar solução ácida, o dispositivo apresentava toxicidade pela liberação de gases.
![Reprodução da montagem da Pilha de Volta. [1]](https://static.mundoeducacao.uol.com.br/mundoeducacao/2023/01/pilha-volta.jpg)
A pilha de Daniell foi desenvolvida mais tarde, em 1836, e é uma evolução da pilha de Volta. Mais segura e eficiente no armazenamento, a pilha de Daniell é construída apenas por duas placas metálicas de cobre e zinco, imersas em soluções aquosas dos respectivos íons.
Leia também: Diferença entre pilhas e baterias
Exercícios resolvidos sobre a pilha de Daniell
Questão 1
(UFPE) Considere uma cela galvânica formada por semicelas padrão de cobre e de zinco, cujos potenciais de redução são os seguintes:
\({Cu}^{2+}\ \left(aq\right)+2\ e^-\ \longrightarrow\ Cu\ \left(s\right); E° = +0,34V\)
\({Zn}^{2+}\ \left(aq\right)+2\ e^-\ \longrightarrow\ Zn\ \left(s\right); E° = -0,76V\)
É correto afirmar que:
a) Os elétrons no circuito externo fluirão do eletrodo de cobre para o eletrodo de zinco.
b) O potencial-padrão da cela é – 0,42 V.
c) Quando o equilíbrio for atingido não haverá diferença de potencial entre os eletrodos.
d) Os íons zinco são reduzidos a zinco metálico.
e) O eletrodo de cobre é o cátodo.
Resolução:
Letra e.
Item a incorreto. Na pilha de Daniell, o eletrodo de zinco é oxidado (perde elétrons), e o eletrodo de cobre é reduzido (recebe elétrons). Assim, o fluxo de elétrons acontece do eletrodo de zinco para o eletrodo de cobre.
Item b incorreto. O potencial padrão da célula é calculado por \(∆E= E°_{cátodo}- E°_{ânodo}=1,10 V\).
Item c incorreto. Mesmo após o ponto de equilíbrio, ainda haverá diferença de potencial entre os eletrodos, pois trata-se de sistemas químicos diferentes.
Item d incorreto. O zinco metálico é oxidado a íons zinco.
Item e correto. O eletrodo de cobre é o cátodo, onde ocorre a reação de redução.
Questão 2
(Vunesp — adaptado) A equação seguinte indica as reações que ocorrem em uma pilha:
\(Zn\ \left(s\right)+\ {Cu}^{2+}\ \left(aq\right)\longrightarrow{Zn}^{2+}\ \left(aq\right)+\ Cu\ \left(s\right)\)
Podemos afirmar que:
a) O zinco metálico é o cátodo.
b) O íon cobre sofre oxidação.
c) O zinco metálico sofre aumento de massa.
d) O cobre é o ânodo.
e) Os elétrons passam dos átomos de zinco metálico aos íons de cobre.
Resolução:
Letra e.
Na pilha de Daniell, o zinco é o ânodo, pois sofre oxidação, e o cobre é o cátodo, pois sofre redução (item a e d incorretos). Os íons cobre sofrem processo de redução, transformando-se em cobre metálico (item b incorreto).
O eletrodo de zinco é oxidado a íons zinco, logo tem diminuição de massa (item c incorreto).
O fluxo de elétrons pelo circuito externo se dá do eletrodo de zinco (oxida) para o eletrodo de cobre (reduz). Item e correto.
Créditos da imagem

