Fatores que alteram a velocidade das reações químicas
Os fatores que alteram a velocidade das reações químicas são ferramentas físico-químicas utilizadas para aumentar ou diminuir a velocidade com que uma reação química ocorre. As principais ferramentas para tal são a alteração da concentração, da superfície de contato, da temperatura e a presença de um catalisador.
Os fatores que alteram a velocidade das reações químicas são tema obrigatório no estudo da Química, pois saber manipular a velocidade de uma reação química é uma das habilidades essenciais que os químicos precisam desenvolver. Tais fatores afetam nossa vida sem nem percebermos. Por exemplo, na forma como se administra um medicamento, na forma como cozinhamos nossos alimentos, na forma como acondicionamos os nossos insumos perecíveis e até mesmo para entender o funcionamento do nosso corpo.
Leia também: Quais são as condições para a ocorrência de reações químicas?
Resumo sobre os fatores que alteram a velocidade das reações químicas
-
Os fatores que alteram a velocidade das reações químicas são um conjunto de ferramentas capazes de alterar a velocidade das reações químicas, seja para aumentá-las, seja para diminui-las.
-
Dentre essas ferramentas estão a concentração, a temperatura, a superfície de contato e os catalisadores.
-
Os catalisadores são substâncias químicas que criam rotas reacionais de menor energia de ativação, sendo regenerados ao longo do processo.
-
O controle da velocidade de uma reação química é uma das habilidades imprescindíveis do profissional de Química.
-
Os fatores que alteram a velocidade das reações químicas possuem impacto direto em nossa vida e estamos constantemente fazendo sua aplicação.
Videoaula sobre os fatores que alteram a velocidade de uma reação química

Fatores que alteram a velocidade das reações químicas
→ Concentração
Segundo a teoria das colisões, para que haja uma reação química é necessário que haja um encontro entre as partículas dos reagentes, ou seja, as partículas dos reagentes precisam colidir entre si. Porém, essa mesma teoria deixa claro que nem toda colisão implica em uma reação química. As colisões que resultam em uma reação química são chamadas de colisões efetivas.
Assim sendo, um aumento da concentração dos reagentes ocasiona um aumento da frequência das colisões, o que quer dizer que mais choques entre as partículas ocorrerão em um mesmo intervalo de tempo. Consequentemente, a probabilidade de haver colisões efetivas é maior.
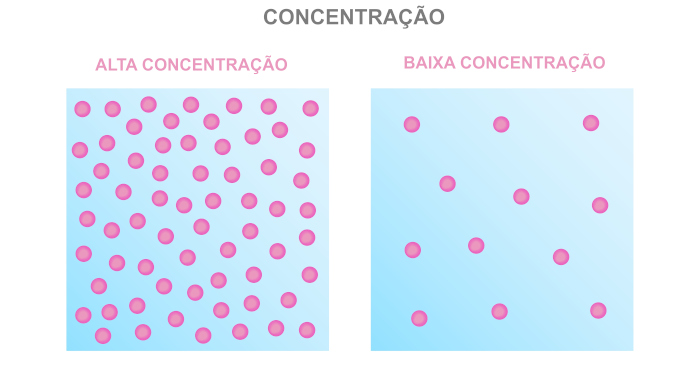
Por isso, é possível dizer que um aumento da temperatura ocasiona um aumento da velocidade da reação química. Do contrário, caso exista uma diminuição da concentração, o inverso será observado (diminuição da velocidade da reação química). A avaliação é a mesma: com a queda da concentração dos reagentes, o número de colisões em um mesmo intervalo de tempo diminui, o que ocasiona a queda da probabilidade de colisões efetivas.

→ Superfície de contato
A superfície de contato é um outro fator que influencia na velocidade da reação química. O aumento na área da superfície de contato dos reagentes faz com que mais partículas participem do processo reacional, acelerando-o.
Isso ocorre porque quanto mais fragmentado estiver o reagente, mais partículas dele participarão na reação química. Consequentemente, mais colisões ocorrerão em um mesmo intervalo de tempo, e, por isso, maior a probabilidade de ocorrência de colisões efetivas, ou seja, maior a velocidade da reação química.
Para entender como a área de contato aumenta com a pulverização do reagente, observe a imagem abaixo.
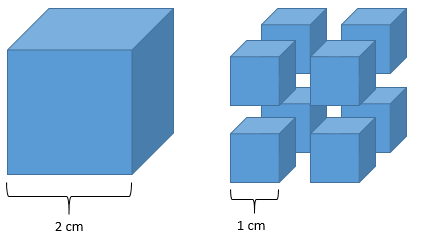
O cubo inteiriço, com 2 cm de aresta, possui uma área de face igual a 4 cm² (2 cm x 2 cm). Se são 6 faces no cubo, podemos dizer que a área superficial total do cubo é igual a 24 cm² (6 x 4 cm²).
Agora, pulverizamos o cubo maior em 8 cubos com aresta de 1 cm. A área da face de um cubo menor será igual a 1 cm² (1 cm x 1 cm). Como são 6 faces, a sua área superficial total será de 6 cm² (6 x 1 cm²). Contudo, agora temos 8 cubos, cada um com uma área superficial total de 6 cm², o que totaliza uma área superficial de 48 cm² (8 x 6 cm²).
Ou seja, ao pulverizar o cubo maior de 2 cm de aresta em 8 cubos menores de 1 cm de aresta, a área superficial dobrou (de 24 cm² para 48 cm²).
Outra forma de aumentar a superfície de contato é por meio da mudança de estado físico. Um reagente líquido possui mais área de contato que um reagente sólido, enquanto um reagente gasoso possui mais área de contato que um reagente líquido.

→ Temperatura
A temperatura é uma medida da energia cinética do corpo, ou seja, mede o grau de agitação das partículas. A energia cinética é calculada mediante a seguinte equação (na qual m é a massa e v é a velocidade):
EC=12⋅mv2
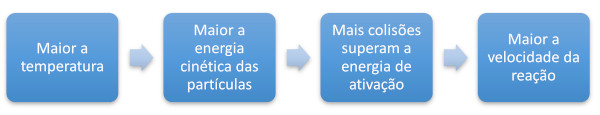
Quanto maior a temperatura, maior a energia cinética, logo mais velozmente as partículas se movimentam. Quando as partículas se movimentam com maior velocidade, as colisões entre elas não só se tornam mais frequentes, mas também mais vigorosas.
Segundo a teoria das colisões, para que uma colisão seja efetiva, ela deve superar a energia de ativação. A energia de ativação é, então, a mínima energia necessária para que uma colisão desencadeie uma reação química. Colisões mais vigorosas (mais energéticas) possuem maior probabilidade de superar a energia de ativação.
Perceba esse efeito no gráfico a seguir. A energia de ativação é representada no eixo horizontal como Emin. A área de cada curva representa o número total de partículas participando da reação química.
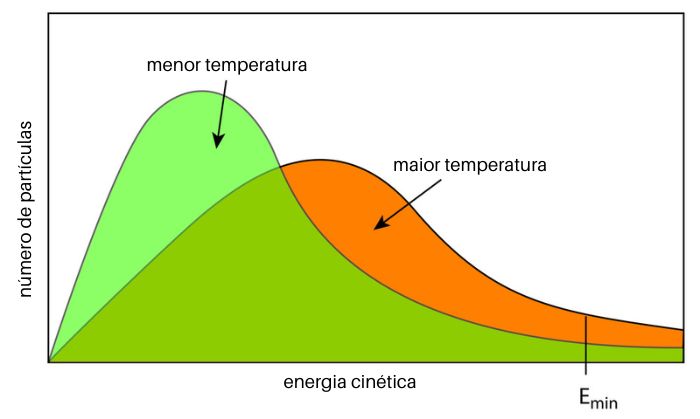
Quando a temperatura aumenta, a energia cinética das partículas se desloca para valores maiores (mais à direita do gráfico). Consequentemente, um maior número partículas possui energia suficiente para superar a energia de ativação (Emin), e, por isso, mais veloz é a reação química.
→ Catalisador
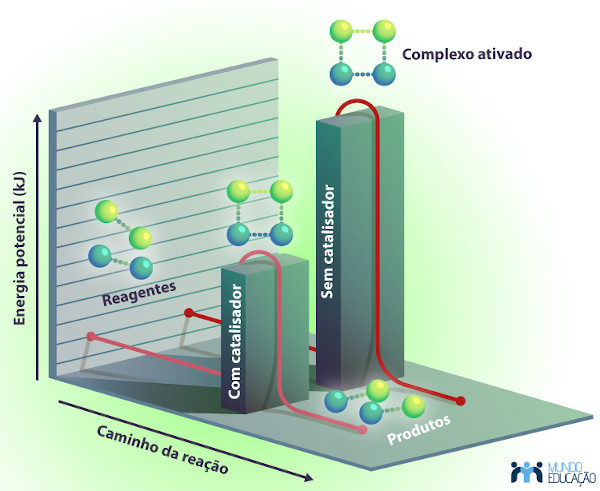
Os catalisadores são caracterizados como substâncias químicas utilizadas para aumentar a velocidade da reação química. O catalisador não é consumido ao longo do processo químico, pois este é regenerado. Tudo isso permite que poucas quantidades dessa substância sejam utilizadas.
Uma vez presente na reação química, o catalisador cria uma rota reacional (um novo caminho para a reação ocorrer) com uma menor energia de ativação, ou seja, com uma barreira energética menor. Sendo a energia de ativação necessária menor, o número de colisões que consegue superar tal barreira energética também aumenta, o que, consequentemente, acelera o processo químico.
Veja também: Quais são os fatores que alteram o equilíbrio químico de um sistema?
Por que os fatores que alteram a velocidade das reações químicas são importantes?
O controle da velocidade das reações químicas, ou seja, saber como acelerá-las ou torná-las mais lentas, é uma das capacidades mais importantes do papel do químico.
Cabe destacar, ainda, que os fatores que alteram a velocidade das reações químicas afetam bastante nossa vida e estão muito presentes nela.

Uma carne moída, por apresentar maior superfície de contato, ficará imprópria para consumo antes de um pedaço inteiro de carne. Essa lógica também é válida ao cortarmos os alimentos para que eles possam ser cozidos mais rapidamente.

A administração de medicamentos por via intravenosa também faz com que os efeitos sejam atingidos mais rapidamente, uma vez que são administrados na forma líquida, e não na forma de comprimidos.
Na reciclagem de alumínio, sendo este um metal muito reativo com o oxigênio presente no ar, é comum manter o metal a ser reciclado em blocos grandes, a fim de diminuir a superfície de contato do alumínio com o ar durante o processo.
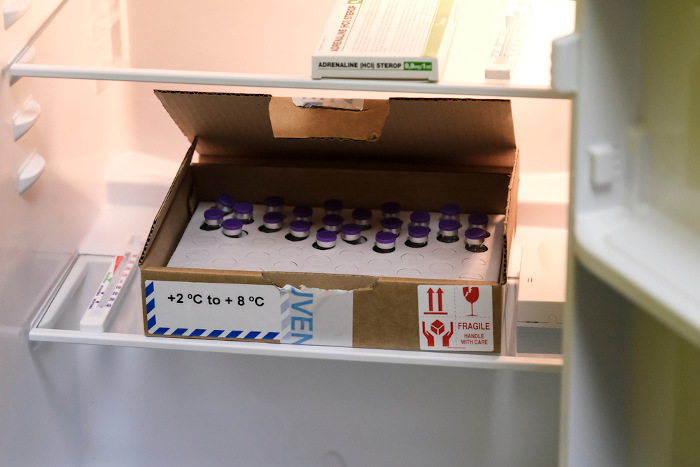
Os freezers e geladeiras são importantes ferramentas para a conservação de insumos. Durante a pandemia de covid-19, soubemos de vacinas sendo transportadas pelo país sem que perdessem sua efetividade, muito por conta da temperatura de acondicionamento. Isso tudo porque menores temperaturas desaceleram processos reacionais, os quais tornariam a vacina imprópria para utilização. Da mesma forma, as geladeiras são itens obrigatórios nos lares, de modo que existem para manter os alimentos frescos e propícios para consumo por um maior tempo.
Por exemplo, as panelas de pressão permitem que a água eleve seu ponto de ebulição pelo aumento da pressão. Com isso, os alimentos cozem mais rapidamente, visto que estão imersos em uma água com temperatura maior do que 100 °C (temperatura normal de ebulição da água).
Dentro do nosso corpo e de outros seres vivos, estão as enzimas. As enzimas são catalisadores biológicos, ou seja, aceleram reações bioquímicas que ocorrem dentro dos organismos de modo a manter um bom funcionamento das atividades biológicas. Imagine, por exemplo, quanto tempo demoraríamos para fazer uma digestão se as enzimas não existissem. Ou melhor, pense nas pessoas que possuem intolerância à lactose, que passam muito mal ao ingerirem leite e seus derivados, justamente por não possuírem a enzima lactase, responsável pela digestão dessa molécula.
O chamado mecanismo de encaixe induzido das enzimas com o substrato, do ponto de vista químico, pode ser visto como uma rota reacional de menor energia de ativação.
Como forma de diminuir a presença de gases nocivos à nossa saúde no meio ambiente, os carros também apresentam, no seu sistema de exaustão, um catalisador. Tal dispositivo tem a função de, em um curto espaço, converter rapidamente qualquer resquício de CO, gases de nitrogênio nocivos (os chamados NOx) e hidrocarbonetos restantes em CO2 e N2, os quais não são nocivos para nossa saúde.

Exercícios resolvidos sobre os fatores que alteram a velocidade das reações químicas
Questão 1
(Unioeste) Geralmente, ao se reunir a família ou um grupo de pessoas, faz-se um churrasco. Esse tipo de confraternização, muito comum no Rio Grande do Sul, se espalhou por todo o Brasil. Para assar a carne, é necessário colocar fogo na churrasqueira, e para não demorar muito para pegar o fogo, geralmente se utilizam gravetos ou pedaços de madeira pequenos em vez de pedaços grandes. Esse fenômeno pode ser explicado quimicamente dentro do tema de cinética. O fator que melhor explica por que a reação de combustão ocorre mais rápido com gravetos (pedaços pequenos de madeira) é
A) velocidade.
B) temperatura.
C) concentração.
D) superfície de contato.
E) estado físico da matéria.
Resolução:
Alternativa D.
Ao utilizar gravetos (mais pulverizado, mais bem dividido) em vez de pedaços grandes, a superfície de contato aumenta, fazendo com que mais moléculas estejam disponíveis para sofrerem a reação de combustão. Por isso, com o aumento da velocidade da reação química, o fogo pega mais rapidamente nessa situação.
Questão 2
(Enem) A nanotecnologia pode ser caracterizada quando os compostos estão na ordem de milionésimos de milímetros, como na utilização de nanomateriais catalíticos nos processos industriais. O uso desses materiais aumenta a eficiência da produção, consome menos energia e gera menores quantidades de resíduos. O sucesso dessa aplicação tecnológica muitas vezes está relacionado ao aumento da velocidade da reação química envolvida.
O êxito da aplicação dessa tecnologia é por causa da realização de reações químicas que ocorrem em condições de
A) alta pressão.
B) alta temperatura.
C) excesso de reagentes.
D) maior superfície de contato.
E) elevada energia de ativação.
Resolução:
Alternativa D.
A utilização de nanomateriais catalíticos coloca as moléculas em uma dimensão da ordem de milionésimos de milímetros. Isso quer dizer que mais moléculas participam do processo químico no mesmo intervalo de tempo, o que caracteriza um aumento da superfície de contato.
Ferramentas Brasil Escola
Artigos Relacionados

Últimas notícias
Outras matérias


















