Hibridização sp3 do carbono
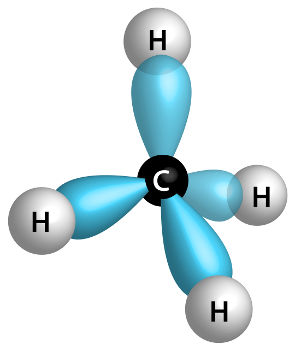
Hibridização sp3 do carbono é um fenômeno físico no qual os três subníveis do tipo p, localizados no segundo nível, unem-se a um subnível do tipo s, também localizado no segundo nível.
A hibridização sp3 é comum em moléculas nas quais o carbono está realizando 4 ligações sigmas com outros quatro átomos (independente do elemento), como, por exemplo, na molécula de metano:
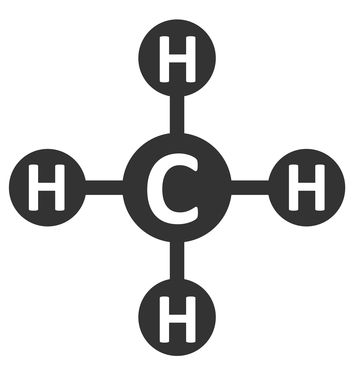
Fórmula estrutural do metano
O carbono realiza apenas quatro ligações porque sofre o fenômeno da hibridização, pois o número de ligações que um átomo realiza está diretamente relacionado com o número de orbitais incompletos. Como em um átomo de carbono existem apenas dois orbitais incompletos, ele deveria fazer fazer apenas 2 ligações.
1- Configuração eletrônica do carbono
Um átomo de carbono apresenta número atômico 6 e sua distribuição eletrônica, no diagrama de Linus Pauling, é assim realizada:
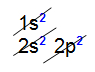
Distribuição eletrônica do carbono no diagrama de Linus Pauling
Através da distribuição eletrônica do carbono, observamos que na sua camada de valência (segundo nível) existem 2 elétrons no subnível s e 2 elétrons no subnível p.
2- Representações dos orbitais no carbono
Abaixo temos uma representação didática dos orbitais e dos elétrons presentes em cada um dos subníveis da camada de valência de um átomo de carbono:
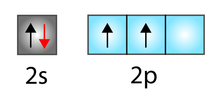
Representação dos orbitais dos subníveis da camada de valência do carbono
Como apresentado na figura, na camada de valência do carbono existe um orbital do subnível s completo (com dois elétrons), enquanto que no subnível p há dois orbitais incompletos (cada um com um elétron) e 1 completamente vazio.
Os orbitais dos subníveis s e p podem ainda ser representados através de formas geométricas: esfera, no caso do subnível s; hélices, no caso do subnível p.
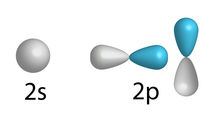
Desenho dos orbitais dos subníveis da camada de valência do carbono
Podemos observar na imagem que apenas dois orbitais p foram representados por hélices, pois um dos orbitais p está vazio.
3- Hibridização sp3 do carbono
Quando um átomo de carbono vai se ligar a outros quatro átomos, através de ligações sigma, recebe, inicialmente, energia do meio externo, fazendo com que um dos elétrons localizados no orbital do subnível s seja deslocado para o orbital vazio do subnível p (denominado estado excitado):
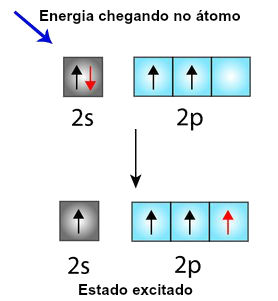
Mudança do orbital s para o orbital p, de um elétron do carbono
Em seguida, os três orbitais do subnível p unem-se ao orbital do subnível s, resultando então em novos quatro orbitais, que são denominados orbitais híbridos sp3.
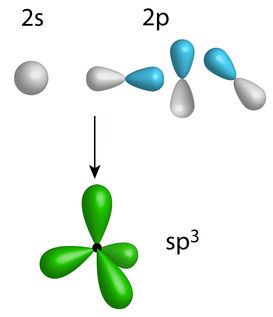
Desenho dos orbitais híbridos sp3 do carbono
Os orbitais híbridos possuem um formato diferente dos orbitais que os originaram.
Ferramentas Brasil Escola

Artigos Relacionados
Clique e entenda passo a passo como ocorre a hibridização do boro e por que ela é conhecida como hibridização do tipo sp2.

Últimas notícias
Outras matérias


























