Isomeria plana
Isomeria plana ou constitucional é um caso de isomeria em que as diferenças estruturais podem ser percebidas com uma análise da fórmula estrutural plana dos compostos. A isomeria é o fenômeno em que dois ou mais compostos diferentes apresentam a mesma fórmula molecular. Ao todo, são cinco casos de isomeria plana:
-
função
-
posição
-
cadeia
-
metameria (ou compensação)
-
tautomeria
Os isômeros planos, apesar de possuírem a mesma fórmula molecular, apresentam propriedades físico-químicas distintas, podendo diferir na reatividade, no ponto de fusão e ebulição, na densidade, na solubilidade em água e outros, o que facilita a separação deles.
Leia também: Como contar os diastereoisômeros?
Resumo sobre isomeria plana
-
Isomeria é o fenômeno em que dois ou mais compostos diferentes podem apresentar a mesma fórmula molecular.
-
A isomeria plana é um caso da isomeria em que as diferenças podem ser percebidas por meio de uma análise da fórmula estrutural plana.
-
Existem cinco tipos de isomeria plana: função, posição, cadeia, compensação e tautomeria.
-
Na isomeria de função, os compostos diferem na função orgânica.
-
Na isomeria de posição, os compostos diferem na posição de ramificações, insaturações ou grupos funcionais.
-
Na isomeria de cadeia, os compostos diferem no tipo de cadeia.
-
Na isomeria de compensação (ou metameria), há diferença na posição do heteroátomo dos compostos.
-
Na tautomeria, há a coexistência de dois compostos de funções orgânicas diferentes por meio de um equilíbrio químico.
Videoaula sobre isomeria plana
O que é isomeria plana?
A isomeria é um fenômeno da química orgânica em que compostos diferentes podem apresentar a mesma fórmula molecular. Os compostos que apresentarem essa característica são então chamados de isômeros entre si. Contudo, essas diferenças podem ser percebidas com uma análise das fórmulas estruturais planas ou por meio de análises espaciais e geométricas da molécula.
Quando as diferenças entre os isômeros são percebidas observando e analisando a fórmula estrutural plana, é porque estamos diante do caso da isomeria plana, também chamada de isomeria constitucional.
Os isômeros planos possuem propriedades físico-químicas diferentes, o que facilita a sua separação com os métodos de separação convencionais. Essas diferenças se dão na reatividade, nos pontos de fusão e ebulição, na solubilidade em água e demais solventes, na densidade, entre outras propriedades importantes no cotidiano da química.
Veja também: O que é um carbono assimétrico ou quiral?
Tipos de isomeria plana
As diferenças nas fórmulas estruturais planas podem ser diversas, algumas mais explícitas, outras mais discretas. Por isso, é essencial dividirmos os isômeros planos em classes diferentes.
-
Isomeria plana de função
Neste caso de isomeria, os compostos possuem a mesma fórmula molecular, porém funções orgânicas diferentes. Algumas funções constituem pares isoméricos clássicos, como os casos a seguir.
-
Álcool e éter
Com o número de carbonos, hidrogênios e oxigênios de um álcool é sempre possível escrever um éter e vice-versa, como é o caso do butan-1-ol e do etóxi-etano, ambos com fórmula C4H10O.
Exemplo:
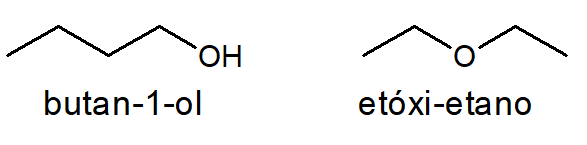
-
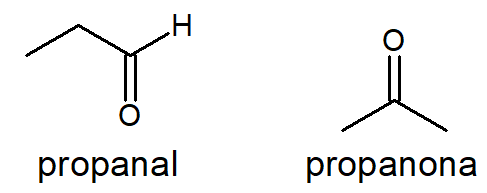
Aldeído e cetona
Com o número de carbonos, hidrogênios e oxigênios de um aldeído é sempre possível escrever uma cetona e vice-versa, como é o caso do propanal e da propanona, ambos com fórmula C3H6O.
Exemplo:
-
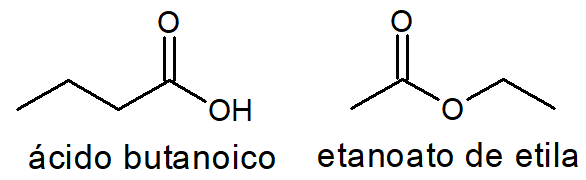
Ácido carboxílico e éster
Com o número de carbonos, hidrogênios e oxigênios de um ácido carboxílico é sempre possível escrever um éster e vice-versa, como é o caso do ácido butanoico e do etanoato de estila, ambos com fórmula C4H8O2.
Exemplo:
-
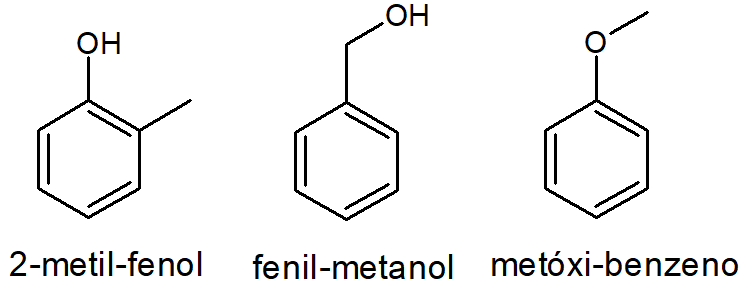
Fenóis
Dentre os fenóis há que se destacar uma coisa. O fenol mais simples, também chamado de hidróxi-benzeno, não possui isômeros planos de função. Contudo, os fenóis substituídos, ou seja, com ramificações no anel, podem ser isômeros de função de álcoois e éteres aromáticos.
É o caso dos metil-fenóis, os quais podem ser isômeros planos de função do álcool fenil-metanol e do éter metóxi-benzeno, ambos com fórmula molecular C7H8O.
Exemplo:
-
Isomeria plana de posição
Ocorre isomeria plana de posição quando, analisando dois isômeros da mesma função orgânica, há diferença na posição de um grupo funcional, insaturação ou ramificação.
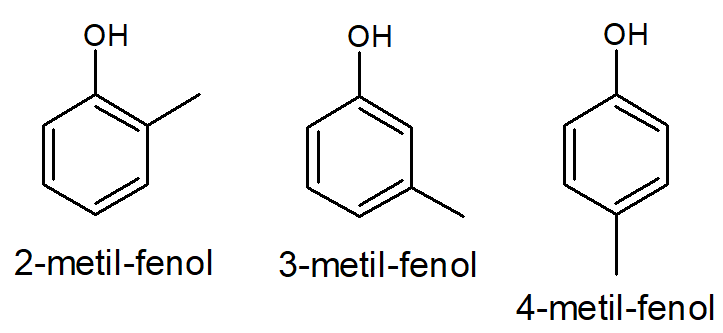
Por exemplo, o composto metil-fenol possui três isômeros de posição:
-
2-metil-fenol (ou orto-metil-fenol)
-
3-metil-fenol (ou meta-metil-fenol)
-
4-metil-fenol (ou para-metil-fenol)
Esses três compostos possuem fórmula molecular C7H8O, pertencem à função orgânica fenol, mas diferem na posição da ramificação metil e, por isso, são considerados isômeros planos de posição.
Exemplo:
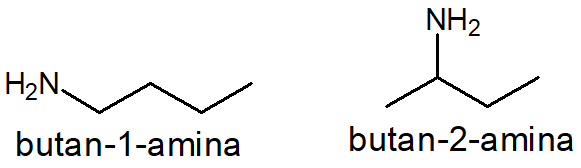
As aminas primárias possuem como grupo funcional o grupo amino monossubstituído (-NH2). Esse grupo funcional pode ocorrer em qualquer carbono de uma cadeia, inclusive nos das extremidades. Por isso, há a possibilidade de duas butanaminas: a butan-1-amina e a butan-2-amina. A diferença entre elas está na posição do grupo amino e, por isso, são isômeros planos de posição.
Exemplo:
As funções orgânicas álcool e cetona também permitem alteração na posição de seu grupo funcional ao longo da cadeia e, por isso, também são passíveis de isomeria plana de posição.
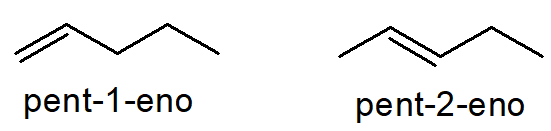
No que diz respeito às insaturações (ligações duplas ou triplas entre carbonos), uma mesma fórmula molecular também pode gerar isômeros com elas em posições diferentes. Por exemplo, os alcenos pent-1-eno e pent-2-eno possuem ambos a fórmula molecular C5H10, contudo, com a ligação dupla em uma posição diferente, e, por isso, são isômeros planos de posição.
Exemplo:
Leia também: Como identificar um carbono quiral?
-
Isomeria plana de cadeia
A versatilidade dos compostos orgânicos também permite um caso de isomeria plana em que os isômeros diferem quanto ao tipo de cadeia.
Em um primeiro caso, podemos ver os hidrocarbonetos de fórmula C6H14. Com essa fórmula molecular, é possível existir o isômero hexano (de cadeia carbônica normal) e o isômero 2,3-dimetil-butano (de cadeia carbônica ramificada). Como pertencem à mesma função e só diferem no tipo de cadeia, esses dois compostos são classificados como isômeros planos de cadeia.
Exemplo:
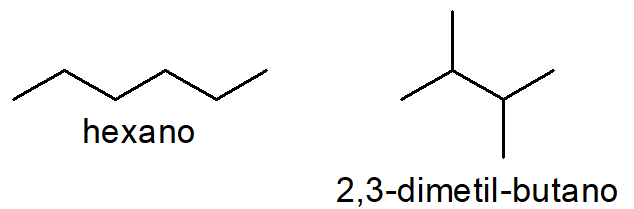
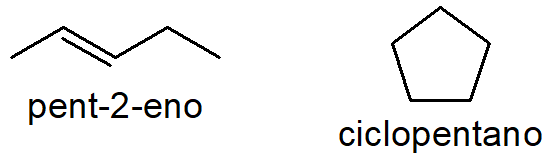
Um caso clássico de isomeria plana de cadeia ocorre entre alcenos e cicloalcanos com mesmo número de carbonos e hidrogênios. Por exemplo, com a fórmula C5H10, é possível escrever tanto o alceno pent-2-eno (de cadeia aberta) quanto o cicloalcano ciclopentano (de cadeia fechada).
Exemplo:
As aminas também podem apresentar outro tipo de isomeria de cadeia. Por exemplo, uma amina primária tem sempre cadeia carbônica homogênea, enquanto aminas secundárias ou terciárias possuem cadeia carbônica heterogênea. Assim, a propan-1-amina, uma amina primária, é isômero plano de cadeia da N-metil-etanamina, uma amina secundária, ambas com fórmula molecular C3H9N.
Exemplo:
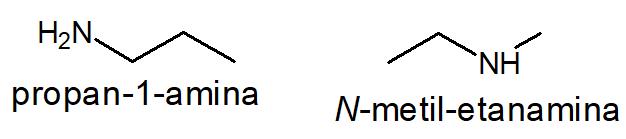
-
Isomeria plana de compensação ou metameria
Na isomeria plana de compensação ou metameria, o que se percebe é uma alteração na posição do heteroátomo dentro da cadeia. Obviamente, esse caso necessita que os compostos sejam heterogêneos, e, por isso, só é possível metameria em:
-
éteres
-
aminas (secundárias e terciárias)
-
ésteres
-
amidas (secundárias ou terciárias)
Um caso simples de perceber é a metameria entre os éteres etóxi-etano e 1-metóxi-propano, ambos com fórmula molecular C4H10O.
Exemplo:
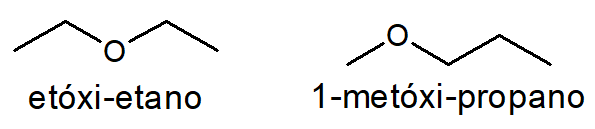
-
Tautomeria
Na tautomeria, os isômeros diferem na função, contudo, coexistem em um equilíbrio químico. Isso quer dizer que ambos existem ao mesmo tempo em uma solução, porém alterarão sua função por meio de um rearranjo dos elétrons.
É o que acontece, por exemplo, com os aldeídos e as cetonas, cujos elétrons π da carbonila podem se rearranjar e formar um enol (função orgânica em que a hidroxila, OH, liga-se a um carbono sp² não aromático).
Quando o aldeído coexiste com o enol, chamamos de equilíbrio aldo-enólico, como se mostra a seguir.
Exemplo:
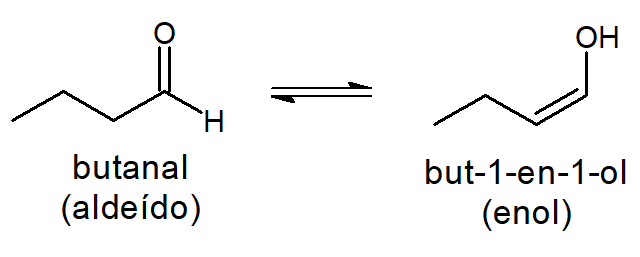
Já quando a cetona coexiste com o enol, chamamos de equilíbrio ceto-enólico, como se mostra a seguir.
Exemplo:
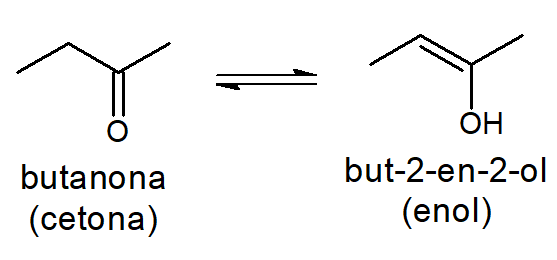
Apesar de terem sua existência confirmada, os enóis são muito instáveis, não conseguindo ser isolados. Por isso, o equilíbrio está praticamente todo deslocado para o aldeído (no equilíbrio aldo-enólico) ou para a cetona (no equilíbrio ceto-enólico). Contudo, ao se avaliar algumas reações orgânicas, vê-se que um produto estável pode ser formado de um enol.
Veja também: Diferença entre diastereoisômeros e enantiômeros
Exercícios resolvidos sobre isomeria plana
Questão 1 - (Uerj 2020) Em uma unidade industrial, emprega-se uma mistura líquida formada por solventes orgânicos que apresentam a fórmula molecular C2H6O. Entre os componentes da mistura, ocorre isomeria plana do seguinte tipo:
A) cadeia
B) função
C) posição
D) compensação
Resolução
Alternativa B
Com a fórmula molecular C2H6O, não é possível uma isomeria de cadeia, pois não é possível termos um composto com cadeia aberta e outro de cadeia fechada, ou até mesmo um com cadeia normal e outro com cadeia ramificada.
A isomeria de posição também não é possível, pois não há como alterar a posição da insaturação. Também não é possível, com dois carbonos, ter um grupo funcional em posições diferentes.
Já a isomeria de compensação não é possível, pois, por mais que se possa criar uma cadeia heterogênea com essa fórmula molecular, não é possível criar duas cadeias heterogêneas diferentes com essa fórmula para que sejam isômeras.
Assim, a única possibilidade restante é de isomeria plana de função, o que de fato ocorre, pois, com a fórmula molecular proposta, é possível montar um álcool (etanol) e um éter (metóxi-metano), os quais são isômeros planos de função. Por isso, o gabarito correto é da letra B.
Questão 2 - (Uerj 2014) Em uma das etapas do ciclo de Krebs, a enzima aconitase catalisa a isomerização de citrato em isocitrato, de acordo com a seguinte equação química:
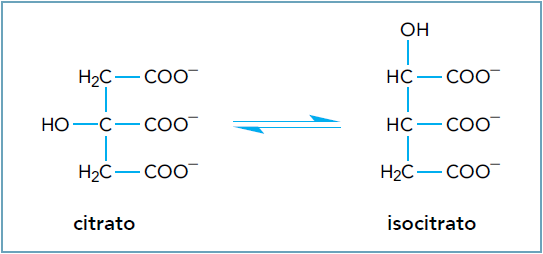
A isomeria plana que ocorre entre o citrato e o isocitrato é denominada:
A) cadeia
B) função
C) posição
D) compensação
Resolução
Alternativa C
Ao se avaliar a imagem, percebe-se que a diferença entre o citrato e o isocitrato é a posição do grupo hidroxila (-OH). Por isso, devemos classificar essa isomeria como uma isomeria plana de posição, alternativa C.