Propriedades específicas da matéria
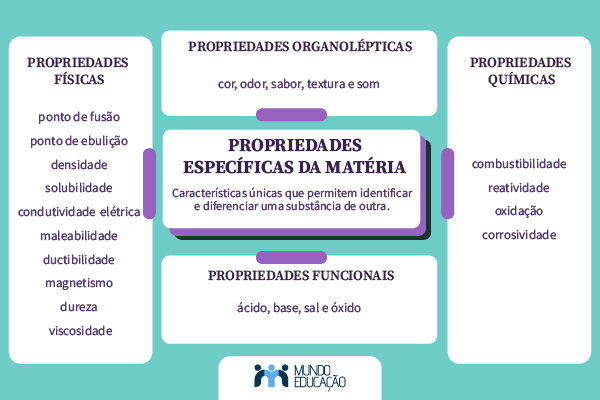
As propriedades específicas da matéria são características únicas que permitem identificar e diferenciar uma substância de outra. Essas propriedades são classificadas em físicas, químicas, organolépticas e funcionais.
Diferentemente das propriedades gerais, como massa e volume, que dependem da quantidade de matéria, as propriedades específicas são intrínsecas e dependem da composição de cada substância, independentemente da quantidade presente.
Leia também: Afinal, o que é matéria?
Resumo sobre propriedades específicas da matéria
-
As propriedades específicas da matéria são divididas em físicas, químicas, organolépticas e funcionais.
- As propriedades físicas são: ponto de fusão (PF), ponto de ebulição (PE), densidade, solubilidade, condutividade elétrica, maleabilidade, ductibilidade, magnetismo, dureza e viscosidade.
- As propriedades químicas são: combustibilidade, reatividade, oxidação e corrosividade.
-
As propriedades organolépticas são características percebidas pelos nossos sentidos, como cor, odor, sabor, textura e som.
-
As propriedades funcionais estão relacionadas à função de uma substância, que pode ser: ácido, base, sal e óxido.
Não pare agora... Tem mais depois da publicidade ;) -
As propriedades gerais são comuns a toda matéria, enquanto as propriedades específicas são características únicas de cada substância.
-
As propriedades físicas são utilizadas para separar, caracterizar e purificar substâncias.
-
As propriedades químicas e funcionais são utilizadas para fins de reações, para produzir uma variedade de produtos.
-
As propriedades organolépticas são utilizadas para controle de qualidade em indústrias alimentícias, além de sistemas de segurança e mecanismos de defesa de animais.
Quais são as propriedades específicas da matéria?
As propriedades específicas da matéria são divididas em físicas, químicas, organolépticas e funcionais. Essas propriedades são fundamentais e conferem identidade a cada substância, permitindo sua caracterização e classificação.
→ Propriedades físicas: são características que podem ser observadas e medidas sem alterar a composição química da matéria, ou seja, elas estão intimamente ligadas às transformações físicas. Essas propriedades são:
- Ponto de fusão (PF): é a temperatura na qual uma substância sólida se transforma em líquida, sob pressão constante.
- Ponto de ebulição (PE): é a temperatura na qual uma substância líquida se transforma em gás, também sob pressão constante.
- Densidade: é uma propriedade física que relaciona a massa de um material com o volume que ele ocupa. Em outras palavras, a densidade indica o grau de compactação da matéria.
A relação matemática da densidade é dada por:
\(d = \frac {m}{V}\)
- d é a densidade, expressa em g/cm3 ou kg/m3;
- m é a massa, medida em gramas (g) ou quilogramas (kg);
- V é o volume, medido em centímetros cúbicos (cm3) ou metros cúbicos (m3).
A densidade é uma propriedade intensiva, ou seja, não depende da quantidade de matéria presente. Ela é uma característica própria de cada substância e pode ser utilizada para identificar e diferenciar materiais. Para saber mais, clique aqui.
- Solubilidade: é a capacidade de uma substância se misturar a outra. Um exemplo muito comum é o sal de cozinha (NaCl), que é altamente solúvel em água, enquanto o óleo é praticamente insolúvel.
- Viscosidade: é a resistência ao escoamento que um fluido apresenta. Isso pode ser facilmente observado no escoamento do mel, que apresenta alta viscosidade, e da água, que apresenta baixa viscosidade.
- Ductibilidade: é a capacidade de um material ser esticado sem sofrer fissuras. O cobre, por exemplo, é um metal altamente dúctil, utilizado na fabricação de fios elétricos.
- Maleabilidade: é a capacidade de um material ser transformado em lâminas finas. O ouro é um metal muito maleável, podendo ser transformado em folhas extremamente finas.
- Condutividade elétrica: é a capacidade de um material conduzir corrente elétrica. A prata é um excelente condutor de eletricidade, por isso é utilizada em componentes eletrônicos. Para saber mais, clique aqui.
- Magnetismo: é a capacidade de um material atrair ou repelir outros materiais magnéticos. O ferro é um exemplo de material magnético, sendo fortemente atraído por imãs. Para saber mais, clique aqui.
- Dureza: é a resistência que um material apresenta à penetração ou à abrasão. O diamante, por exemplo, é o material natural mais duro conhecido.
→ Propriedades químicas: descrevem a capacidade de uma substância de sofrer transformações químicas, ou seja, mudanças que alteram sua composição molecular. As propriedades químicas são:
- Combustibilidade: é a capacidade de uma substância reagir com oxigênio (O₂) e liberar energia na forma de calor e luz. Essa propriedade caracteriza materiais inflamáveis. Um exemplo é o metano (CH4), um gás natural que é altamente combustível. Quando queimado, reage com o oxigênio em uma combustão completa:
CH4(g) + 2 O2(g) → CO2(g) + 2 H2O(l) + energia
- Reatividade: é a tendência de uma substância participar de reações químicas, especialmente com outros compostos ou elementos. Pode incluir interações com ácidos, bases, metais ou água. Por exemplo, o sódio metálico (Na) é altamente reativo com a água. A reação gera hidróxido de sódio (NaOH) e gás hidrogênio (H₂), podendo ser explosiva:
2 Na(s) + 2 H2O(l) → 2 NaOH(s) + H2(g)
- Oxidação: é a perda de elétrons por uma substância durante uma reação química, geralmente envolvendo oxigênio. É parte de reações de oxirredução (redox). O ferro (Fe), por exemplo, oxida em presença de oxigênio e umidade, formando ferrugem (óxido de ferro):
4 Fe(s) + 3 O2(g) + 6 H2O(l) → 4 Fe(OH)3(s)
Com o tempo, o Fe(OH)3 desidrata, formando o óxido de ferro (Fe2O3·nH2O).
- Corrosividade: é a capacidade de uma substância, como ácidos ou bases fortes, de destruir ou deteriorar materiais, especialmente metais e tecidos orgânicos. Um exemplo é o ácido clorídrico (HCl), que reage com o zinco (Zn), corroendo-o e liberando gás hidrogênio:
Zn(s) + 2 HCl(aq) → ZnCl2(s) + H2(g)
→ Propriedades organolépticas: aquelas percebidas pelos nossos sentidos, como a visão, o olfato, o paladar, o tato e a audição. Essas propriedades são subjetivas e podem variar de pessoa para pessoa. As propriedades organolépticas mais comuns são:
- Cor: a percepção visual da luz refletida por um objeto.
- Odor: a percepção olfativa de substâncias voláteis.
- Sabor: a percepção gustativa de substâncias em contato com as papilas gustativas.
- Rugosidade: a sensação tátil de aspereza ou suavidade.
- Rigidez: a resistência de um material à deformação.
- Maleabilidade: a capacidade de um material ser moldado.
→ Propriedades funcionais: aquelas relacionadas ao comportamento específico de uma substância em determinadas reações químicas. As principais funções químicas são:
- Ácidos: substâncias que, em solução aquosa, liberam íons H⁺. Um exemplo é a dissolução do ácido clorídrico (HCl) em água, que compõe o suco gástrico e ajuda no processo de digestão dos alimentos. A dissolução do HCl em água pode ser descrita através seguinte equação química:
HCl(g) + H2O(l) → H+(aq) + Cl⁻(aq)
- Bases: substâncias que, em solução aquosa, liberam íons OH⁻. Um exemplo é a dissolução do hidróxido de sódio (NaOH), também conhecido como soda cáustica, muito utilizada em produtos de limpeza. A dissolução do NaOH em água pode ser descrita através seguinte equação química:
NaOH(s) + H2O(l) → Na+(aq) + OH⁻(aq)
- Sais: compostos iônicos formados pela reação de neutralização entre um ácido e uma base. Entre os vários sais que encontramos no dia a dia, destaca-se o cloreto de sódio (NaCl), também chamado de sal de cozinha devido a sua ampla aplicação como condimento na culinária. A reação de neutralização que leva à formação do NaCl é descrita através da seguinte equação química:
HCl(g) + NaOH(s) → NaCl(aq) + H2O(l)
- Óxidos: compostos binários nos quais o oxigênio é o elemento mais eletronegativo. Um óxido comum é o óxido férrico (Fe2O3), muito conhecido como ferrugem, cuja formação é descrita na equação a seguir.
4 Fe(s) + 3 O2(g) → 2 Fe2O3(s)
Quais as diferenças entre propriedades gerais e propriedades específicas da matéria?
As propriedades gerais são comuns a toda matéria e dependem da quantidade de matéria presente, como massa e volume. Já as propriedades específicas são características únicas de cada substância e independem da quantidade de matéria, como densidade, ponto de fusão e ponto de ebulição.
Leia também: Propriedades intensivas e extensivas — uma forma de classificar as propriedades físicas
Exercícios sobre propriedades específicas da matéria
Questão 1
(UFMG) Uma amostra de uma substância pura X teve algumas de suas propriedades determinadas. Todas as alternativas apresentam propriedades que são úteis para identificar essa substância, exceto:
A) densidade.
B) massa da amostra.
C) solubilidade em água.
D) temperatura de ebulição.
E) temperatura de fusão.
Resolução: A resposta correta é a alternativa B): massa da amostra.
Analisando as alternativas:
- A) Densidade: a densidade é uma propriedade característica de cada substância e depende da sua massa e volume. É uma propriedade intensiva, ou seja, não depende da quantidade de matéria. Portanto, a densidade é uma propriedade útil para identificar uma substância.
- B) Massa da amostra: a massa é uma propriedade extensiva, ou seja, depende da quantidade de matéria. A massa de uma amostra pode variar, mas a densidade, que relaciona a massa com o volume, permanece constante para determinada substância. A massa em si não é suficiente para identificar uma substância.
- C) Solubilidade em água: a solubilidade é a capacidade de uma substância se dissolver em outra. É uma propriedade específica de cada substância e pode ser utilizada para diferenciá-las.
- D) Temperatura de ebulição: a temperatura de ebulição é a temperatura na qual uma substância passa do estado líquido para o gasoso. É uma propriedade característica de cada substância pura e, portanto, pode ser utilizada para identificá-la.
- E) Temperatura de fusão: a temperatura de fusão é a temperatura na qual uma substância passa do estado sólido para o líquido. Assim como a temperatura de ebulição, é uma propriedade característica e pode ser utilizada para identificar uma substância.
Dessa forma, a massa da amostra é a única propriedade que não é específica de uma substância e, portanto, não pode ser utilizada para identificá-la.
Questão 2
(Ufal) Uma pessoa comprou um frasco de álcool anidro. Para se certificar de que o conteúdo do frasco não foi fraudado com a adição de água, basta que ela determine, com exatidão,
- a densidade
- o volume
- a temperatura de ebulição
- a massa
Dessas afirmações, são corretas SOMENTE
A) I e II.
B) I e III.
C) I e IV.
D) II e III.
E) III e IV.
Resolução: A resposta correta é a alternativa B): I e III.
Análise das afirmações:
- I. A densidade: a densidade é uma propriedade intensiva da matéria, ou seja, não depende da quantidade de substância. A densidade do álcool anidro é conhecida e relativamente constante. Ao medir a densidade do líquido no frasco, a pessoa pode comparar o valor obtido com o valor de referência para o álcool anidro. Se o valor for diferente, é um forte indicativo de que o líquido foi adulterado com água.
- II. O volume: o volume informa a quantidade de líquido no frasco, mas não fornece informações sobre a pureza do álcool. Mesmo que o volume esteja correto, o líquido pode estar diluído com água.
- III. A temperatura de ebulição: a temperatura de ebulição é outra propriedade característica de uma substância pura. A adição de água ao álcool anidro eleva a temperatura de ebulição da mistura. Portanto, ao medir a temperatura de ebulição do líquido, é possível verificar se ele é puro ou se contém impurezas.
- IV. A massa: a massa informa apenas a quantidade de matéria presente no frasco, não oferecendo informações sobre a composição do líquido. Assim como o volume, a massa não é suficiente para determinar a pureza do álcool.
Dessa forma, as propriedades mais relevantes para verificar a pureza do álcool anidro são a densidade e a temperatura de ebulição. Ao comparar os valores medidos com os valores de referência para o álcool puro, é possível detectar a presença de adulterantes como a água.
Fontes
BROWN, Theodore L. et al. Química: a ciência central. 9.ed. São Paulo: Prentice Hall, 2005.
CHANG, Raymond. Química Geral: Conceitos Essenciais; 4ªed.; São Paulo; McGraw-Hill; 2007.