Tipos de Geometria molecular

Conhecer o tipo de geometria de uma molécula é importante, porque essa característica oferece-nos uma noção sobre diversas propriedades e comportamentos das substâncias, como:
- Polaridade;
- Solubilidade;
- Força intermolecular;
- Dureza;
- Ponto de fusão;
- Ponto de ebulição;
Para saber o tipo de geometria molecular, dependemos de alguns fatores fundamentais, como quantidade de átomos e número de nuvens eletrônicas presentes no átomo central da molécula.
Acompanhe a seguir os principais tipos de geometria molecular e suas características:
Geometria linear
Tipo de geometria molecular em que os átomos ocupam os polos de um plano linear (de uma linha), representado segundo o modelo abaixo:
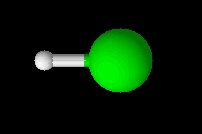
Forma de representação de uma geometria linear
Esse tipo de geometria está presente em moléculas diatômicas, ou seja, que possuem dois átomos (iguais ou diferentes) em sua constituição, e ainda em moléculas triatômicas (que apresentam três átomos). Porém, o átomo central em moléculas triatômicas não pode apresentar um par de elétrons, da camada de valência, não ligantes (que não participam de ligação química). Exemplos:
-
Gás carbônico (CO2): O carbono dessa molécula tem quatro elétrons na camada de valência e utiliza os quatro nas ligações com os átomos de oxigênio;
-
ácido cianídrico (HCN): O carbono dessa molécula apresenta quatro elétrons na camada de valência e utiliza os quatro nas ligações com os átomos de hidrogênio e oxigênio.
O ângulo encontrado entre os átomos, nessa geometria, é de aproximadamente 180o.
Geometria angular
Tipo de geometria molecular em que os átomos ocupam os polos de um plano diagonal ao átomo central, que costuma ser representado segundo o modelo abaixo:
Forma de representação de uma geometria angular
Essa geometria ocorre em moléculas triatômicas, porém, o átomo central dessas moléculas deve apresentar pelo menos um par de elétrons, da camada de valência, não ligantes (que não participam de ligação química). Exemplos:
-
Dióxido de enxofre (SO2): Nessa molécula, o enxofre tem seis elétrons na camada de valência e utiliza apenas quatro nas ligações com os átomos de oxigênio, sobrando um par não ligante;
-
Água (H2O): O oxigênio tem seis elétrons na camada de valência e utiliza apenas dois nas ligações com os átomos de hidrogênio, sobrando dois pares não ligantes.
Moléculas com geometria angular que possuem apenas um par de elétrons não ligantes no átomo central apresentam um ângulo entre os átomos de 120o. Já as aquelas que possuem duas nuvens apresentam um ângulo de 109o 28'.
Trigonal plana
Tipo de geometria molecular em que os átomos da molécula ocupam os polos de um triângulo regular, comumente representado segundo o modelo abaixo:
Forma de representação de uma geometria trigonal
Esse tipo de geometria ocorre em moléculas tetratômicas, ou seja, que possuem quatro átomos em sua constituição, porém o átomo central dessa molécula não pode apresentar um par de elétrons da camada de valência não ligantes. Exemplos:
-
Amônia (BF3): O boro tem três elétrons na camada de valência e utiliza os três nas ligações com os átomos de flúor;
-
Trióxido de enxofre (SO3): O enxofre tem seis elétrons na camada de valência e utiliza os seis nas ligações com os oxigênios.
O ângulo encontrado entre os átomos, nessa geometria, é de aproximadamente 120o.
Piramidal ou pirâmide trigonal
Tipo de geometria molecular em que os átomos da molécula ocupam os polos de uma pirâmide regular, geralmente representada segundo o modelo abaixo:
Forma de representação de uma geometria piramidal
Essa geometria ocorre em moléculas tetratômicas, ou seja, que possuem quatro átomos em sua constituição. Porém, seu átomo central deve apresentar um par de elétrons da camada de valência não ligantes. Exemplos:
-
Amônia (NH3): O nitrogênio tem cinco elétrons na camada de valência, porém utiliza somente três nas ligações com os hidrogênios;
-
Tricloreto de fósforo (PCl3): O fósforo tem cinco elétrons na camada de valência, porém utiliza somente três nas ligações com os cloros.
O ângulo encontrado entre os átomos dessa geometria é de cerca de 109o28'.
Tetraédrica
Tipo de geometria molecular em que os átomos da molécula ocupam os polos de um tetraedro regular, comumente representado segundo o seguinte modelo:
Forma de representação de uma geometria tetraédrica
Essa geometria está presente em moléculas ou grupos iônicos pentatômicos, ou seja, que possuem cinco átomos em sua constituição. Exemplos:
-
Metano (CH4);
-
Cátion hidrônio (NH4+).
O ângulo encontrado entre os átomos dessa geometria é de aproximadamente 109o28'.
Bipiramidal
Tipo de geometria molecular em que os átomos da molécula ocupam os polos de um tetraedro regular, representado segundo o modelo abaixo:
Forma de representação de uma geometria bipiramidal
Essa geometria aparece em moléculas ou grupos iônicos hexatatômicos, ou seja, que possuem seis átomos em sua constituição. Exemplo:
-
Pentacloreto de fósforo (PCl5).
O ângulo encontrado entre os átomos, nessa geometria, varia de 90º a 120o.
Octaédrica
Tipo de geometria molecular em que os átomos da molécula ocupam os polos de um octaedro regular, representado de acordo com o seguinte modelo:
Forma de representação de uma geometria octaédrica
Essa geometria aparece em moléculas ou grupos iônicos heptatômicos, ou seja, que possuem sete átomos em sua constituição. Exemplo:
-
Hexafloreto de enxofre (SF6).
O ângulo encontrado entre os átomos, nessa geometria, é de aproximadamente 90o.



