Ciclo de Carnot
O ciclo de Carnot é o processo teorizado por Sadi Carnot que idealiza o funcionamento do motor mais próximo ao do ideal. Ele opera em quatro etapas: a primeira consiste em uma expansão isotérmica (absorção de energia à temperatura constante); a segunda, em uma expansão adiabática (variação de pressão, temperatura e volume do gás sem trocas de calor); a terceira, em uma compressão isotérmica (a energia diminui, e a temperatura se mantém); e a quarta, em uma compressão adiabática (conservação da energia, mas queda da temperatura).
Esse processo surgiu em resposta a uma pergunta feita no início do século XIX, que questionava o que deveria ser feito para melhorar a eficiência de uma máquina térmica, já que, de acordo com a segunda lei da Termodinâmica, não existe máquina perfeita. Logo, Sadi Carnot, assessor científico de Napoleão Bonaparte, determinou que a eficiência máxima de uma máquina térmica poderia ser obtida utilizando uma fonte fria e outra quente, fazendo assim um processo reversível de transformações gasosas.
Leia também: O que a Termodinâmica estuda?
Resumo sobre o ciclo de Carnot
-
O ciclo de Carnot opera com transformações gasosas em quatro etapas: uma expansão isotérmica, uma expansão adiabática, uma compressão isotérmica e uma compressão adiabática.
-
A transformação gasosa isotérmica é aquela em que a temperatura é constante.
-
A transformação gasosa adiabática é aquela em que não ocorrem trocas de calor com o ambiente.
-
Carnot elaborou uma teoria que faz com que uma máquina opere entre duas temperaturas. Com isso, obtém-se a maior eficiência possível de uma máquina térmica.
-
As trocas de calor no ciclo de Carnot ocorrem na primeira etapa, em que é absorvido calor da fonte quente, e na terceira etapa, em que o calor que não foi convertido em trabalho é transmitido para a fonte fria.
-
O rendimento do ciclo de Carnot sempre será inferior a 100%, já que para isso ocorrer todo o calor absorvido pela fonte quente deveria ser convertido em trabalho.
Videoaula sobre o ciclo de Carnot e as máquinas térmicas
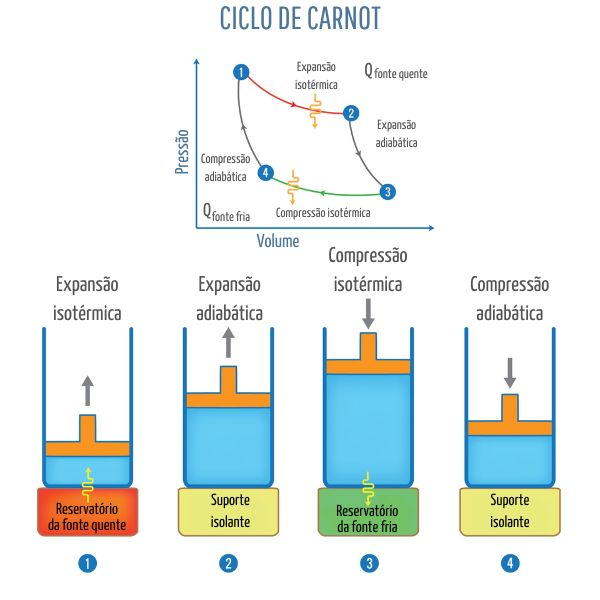
Etapas do ciclo de Carnot
O ciclo de Carnot, criado por Nicolas Léonard Sadi Carnot, idealiza uma máquina térmica em que se pode obter a máxima eficiência possível. Ela opera alternando entre dois tipos de transformações gasosas nas quatro etapas citadas a seguir.
-
Primeira — expansão isotérmica: o gás absorve calor de uma fonte quente, com isso ele dilata e empurra as paredes do recipiente onde se encontra, realizando um trabalho, porém sua temperatura permanece constante.
-
Segunda — expansão adiabática: o gás para de receber calor da fonte quente, com isso sua energia total é conservada, porém sua pressão, temperatura e volume são alterados — o volume continua se expandindo, porém a pressão e a temperatura são reduzidas.
-
Terceira — compressão isotérmica: o gás é colocado em contato com o reservatório da fonte fria, porém sua temperatura é mantida e sua energia interna é reduzida, logo seu volume é reduzido, porém sua pressão aumenta levemente.
-
Quarta — compressão adiabática: nessa última etapa, o gás é afastado da fonte fria e não há troca de calor, com isso a temperatura aumenta e consequentemente o volume também, mas como a pressão é reduzida, a energia interna é conservada.
Após a quarta etapa, o gás é novamente aproximado da fonte quente, e o ciclo recomeça. A imagem a seguir contém o gráfico da pressão em função do volume que representa o ciclo de Carnot, junto a ilustrações de um recipiente que contém um gás.
Teoria de Carnot
A teoria de Nicolas Léonard Sadi Carnot foi elaborada para responder a um questionamento feito no início do século XIX: qual é a forma de tornar uma máquina térmica o mais eficiente possível? De acordo com Carnot, o valor máximo do rendimento de uma máquina será sempre inferior a 100%. Isso ocorre porque a quantidade de trabalho que ela consegue realizar é limitada e inferior à quantidade de calor que ela recebe.
O modelo teórico do motor de Carnot é ideal, porém para sua construção e aplicação prática, é inviável por causa dos dois fatores a seguir:
-
O tempo para que a troca de calor ocorra de forma adequada teria que ser infinito, logo, em termos de potência, que é a razão entre energia e tempo, ela seria nula.
\(P=\frac{E}t\)
Quanto maior o valor do tempo t, menor é a potência.
-
Para que o gás volte à condição inicial, é necessária uma quantidade de energia além daquela descrita pelo modelo de Carnot. Dessa forma, a eficiência do motor já se torna reduzida, e como a máquina deve ser utilizada continuamente, esse déficit de energia se torna maior a cada ciclo.
A condição para que uma máquina térmica tenha um rendimento de 100% é que a fonte fria deve ter a temperatura de 0 K (zero absoluto ou -273 °C), o que é impossível, já que essa é uma condição teórica em que a entropia é nula, ou seja, os átomos não se movem.
Leia também: Qual é a diferença entre calor e temperatura?
Como ocorre a troca de calor na máquina de Carnot?
No ciclo de Carnot, a troca de calor ocorre em duas das etapas. Na primeira, que é a expansão isotérmica, o gás recebe calor da fonte quente, ou seja, que apresenta uma temperatura maior que a do gás. Quando o gás recebe essa energia térmica, ele tem seu volume aumentado, e isso faz com ele empurre as paredes do recipiente e realize um trabalho. O aumento do volume, redução de pressão e realização do trabalho equivalem ao calor recebido, logo a temperatura permanece a mesma.
A segunda troca de calor ocorre na terceira etapa, na compressão isotérmica. Nessa etapa, o gás é colocado em contato com a fonte fria, que apresenta uma temperatura inferior àquela do gás em repouso. Quando o contato ocorre com o gás, a fonte fria absorve a energia recebida da fonte quente que não realizou o trabalho, que ainda estava contida no gás. Com isso, sua energia interna diminui, voltando ao valor original antes do contato com a fonte quente. Por ter seu volume reduzido e um pequeno aumento da sua pressão, a temperatura se mantém constante novamente.
Fórmula do rendimento da máquina de Carnot
O ciclo de Carnot estabelece uma relação entre:
-
o calor provido pela fonte quente QQ (medido em joule J);
-
o calor cedido para a fonte fria Qf (medido em joule J);
-
a temperatura TQ (medida em kelvin K) da fonte quente;
-
a temperatura TF (medida em kelvin K) da fonte fria.
A relação entre eles é dada pela equação a seguir.
\(\frac{Q_Q}{Q_F} =\frac{T_Q}{T_F} \)
O rendimento, em porcentagem, equivale à razão entre a diferença entre as quantidades de calor pela quantidade de calor da fonte quente.
\(η=(\frac{Q_Q-Q_F)}{Q_Q})\cdot100\%=(1-\frac{Q_F}{Q_Q})\cdot100\%\)
Como a razão entre as quantidades de calor fornecido e absorvido é igual à razão entre as suas respectivas temperaturas, o rendimento pode ser reescrito em função das temperaturas das fontes.
\(η=(1-\frac{T_F}{T_Q})\cdot100\%\)
Exemplos:
-
Calcule o rendimento de uma máquina térmica fictícia que funciona de acordo com o ciclo de Carnot, em que a quantidade de calor fornecida pela fonte quente para o gás é de 2000 J e o calor absorvido pela fonte fria é de 1600 J.
Extraindo os dados do problema:
-
QQ = 2000 J
-
QF = 1600 J
-
η = ?
\(η=(1-\frac{Q_F}{Q_Q} )\cdot100\%=(1-\frac{1600}{2000})\cdot100\%=(1-0,8)\cdot100\%\)
\(η=0,2\cdot100\%=20\%\)
-
Em uma máquina térmica, operando pelo ciclo de Carnot ou não, o calor recebido é parte convertido em trabalho e parte absorvido pela fonte fria. Considere que o gás absorveu 4000 J e a fonte fria absorveu 3600 J. Qual foi o trabalho realizado pelo gás?
Extraindo os dados do problema:
-
QQ = 4000 J
-
QF = 3600 J
O trabalho será representado por W (work, no idioma inglês). O trabalho equivale à diferença entre o calor fornecido pela fonte quente e o calor absorvido pela fonte fria.
\(W=Q_Q-Q_F=4000-3600=400\ J\)
Leia também: Quais são as transformações termodinâmicas?
Exercícios resolvidos sobre o ciclo de Carnot
Questão 1
O rendimento de uma máquina térmica fictícia que opera obedecendo ao ciclo de Carnot é de 25%. Considerando que a temperatura da fonte quente é 800 K, qual é a temperatura da fonte fria?
a) 900 K
b) 200 K
c) 600 K
d) 450 K
e) 300 K
Resposta
Letra C
Extraindo os dados do problema
-
η = 25%
-
TQ = 800 K
-
TF = ?
\(η=(1-\frac{T_F}{T_Q})\cdot100\%\)
\(25\%=(1-\frac{T_F}{800})\cdot100\%\)
\(\frac{25\%}{100\%}=(1-\frac{T_F}{800})\)
\(0,25=1-\frac{T_F}{800}\)
Invertendo ambos os lados da equação.
\(1-\frac{T_F}{800}=0,25\)
\(-\frac{T_F}{800}=0,25-1\)
\(-\frac{T_F}{800}=-0,75\)
Multiplicando ambos os lados por -1, para deixar a incógnita positiva.
\(\frac{T_F}{800}=0,75\)
\(T_F=0,75\cdot800=600\ K\)
Questão 2
Em relação ao ciclo de Carnot e máquinas térmicas, marque a alternativa incorreta.
a) O ciclo de Carnot é composto por dois tipos de transformações gasosas: isotérmica e adiabática.
b) Na segunda etapa do ciclo de Carnot, como o gás não recebe calor da fonte quente, a sua temperatura permanece constante.
c) A máquina térmica ideal seria aquela em que a fonte fria pudesse atingir o zero absoluto, porém é uma situação hipotética, já que se trata de uma temperatura totalmente teórica.
d) O ciclo de Carnot é impossível de ser realizado na prática porque as trocas de calor entre as fontes e o gás levariam um tempo demasiadamente grande, fazendo com que a potência da máquina térmica tendesse a zero.
e) No ciclo de Carnot, quanto menor a diferença entre as temperaturas das fontes, menor é o rendimento da máquina térmica.
Resposta
Letra B
a) Correta. Embora o ciclo seja composto por quatro etapas, há apenas dois tipos de transformações gasosas: isotérmica e adiabática.
b) Incorreta. Na segunda etapa, ocorre a expansão adiabática, em que realmente não ocorrem trocas de calor. Porém, como ocorre variação na pressão e volume do gás e realização de trabalho, ocorre variação na temperatura do gás.
c) Correta. Quanto menor a temperatura da fonte fria, mais eficiente é a máquina. Como o zero absoluto é totalmente teórico, a máquina térmica ideal não é possível.
d) Correta. A fórmula da potência diz que ela é igual à razão entre a energia consumida ou o trabalho realizado pelo tempo \((P=\frac{W}t)\), logo se o tempo for muito grande, a potência será nula, já que são inversamente proporcionais.
e) Correta. De acordo com fórmula, o rendimento de uma máquina térmica equivale à diferença entre 1 e a razão entre a temperatura da fonte fria com a temperatura da fonte quente.
\(η=(1-\frac{T_F}{T_Q})\cdot100\%\)
Se as temperaturas forem muito próximas, a razão terá um valor elevado. Consequentemente, ao serem subtraídas de um, o valor será mais baixo, logo o rendimento será baixo.

