Deslocamento em equilíbrios iônicos
O deslocamento em equilíbrios iônicos segue o princípio de Le Chatelier da mesma forma que um equilíbrio envolvendo um processo químico sem íons. Assim, todos os sistemas sempre tendem a minimizar uma perturbação sofrida para retornar ao estado de equilíbrio.
No caso dos equilíbrios iônicos, a variação da pressão do sistema não promove o seu deslocamento porque eles quase sempre ocorrem em soluções, principalmente em meio aquoso. O que mais influencia um equilíbrio iônico é a temperatura e a concentração (quantidade de íon ou substância).
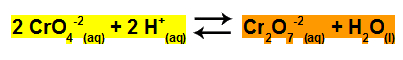
Temos um equilíbrio iônico quando uma reação química ocorre em um solvente e possui pelo menos um íon. Quando os sais cromato de potássio (K2CrO4) e dicromato de potássio (K2Cr2O7), por exemplo, são dissolvidos em água com presença de ácido sulfúrico, forma-se o seguinte equilíbrio iônico:
.jpg)
Equilíbrio iônico entre os sais K2CrO4 e K2Cr2O7
Nesse equilíbrio iônico, os íons cromato transformam-se em íons dicromato na reação direta (para a direita), e os íons dicromato transformam-se em íons cromato na reação inversa (para a esquerda).
OBS.: No equilíbrio, não foi representado o potássio (K) porque ele faz parte dos dois sais que foram utilizados. O sulfato (SO4-2) do ácido também não foi representado porque é um ânion oriundo de um ácido forte e, por isso, não interage com nenhum componente do equilíbrio ou adicionado a ele.
Quando o cromato (CrO4-2) está na presença de ácido, forma uma solução de cor amarela. O dicromato (Cr2O7-2), quando dissolvido em água, forma uma solução de cor alaranjada. Quando juntos em um equilíbrio iônico, não percebemos a prevalência de nenhuma das duas cores.
Representação da coloração de reagentes e produtos do equilíbrio
Se ocorrer uma perturbação no sistema, poderemos ter o deslocamento desse equilíbrio iônico e, com isso, ocorrer a prevalência de uma cor. Veja possíveis casos de perturbação em um equilíbrio iônico:
1- Adição de íon ou substância que participa do equilíbrio
-
a) Adição de um ácido forte como o HBr
Como o ácido bromídrico é um ácido forte, logo, em solução, sofre ionização e produz muitos cátions hidrônio (H+) e ânions brometo (Br-) no meio a que foi adicionado:
.jpg)
Equação de ionização do HBr
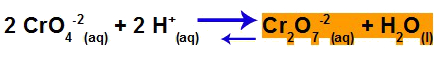
A ionização do HBr fornece ao equilíbrio (CrO4-2/ Cr2O7-2) o íon H+, como podemos observar:
.jpg)
Equilíbrio iônico entre os sais K2CrO4 e K2Cr2O7
Nesse exemplo, teremos deslocamento do equilíbrio da direita e a prevalência da coloração alaranjada. Isso ocorre porque, segundo o princípio de Le Chatelier, quando há o aumento da concentração (quantidade) de um componente do equilíbrio, imediatamente o equilíbrio desloca-se no sentido de consumi-lo.
Resultado do deslocamento do equilíbrio após adição de HBr
2- Adição de íon ou substância que reage com componentes do equilíbrio
-
a) Adição de uma base forte como o Ca(OH)2
Como o hidróxido de cálcio [Ca(OH)2] é uma base forte, logo, em solução, sofre dissociação e libera muitos cátions cálcio (Ca+2) e ânions hidróxido (OH-) no meio a que foi adicionado:
.jpg)
Equação de dissociação do Ca(OH)2
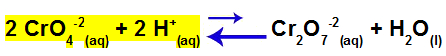
A dissociação do Ca(OH)2 fornece ao equilíbrio (CrO4-2/ Cr2O7-2) o íon OH-, o qual tem grande afinidade com os íons H+ presentes no equilíbrio:
.jpg)
Equilíbrio iônico entre os sais K2CrO4 e K2Cr2O7
Quando os íons OH- e H+ interagem, ocorre a formação da substância água:
.jpg)
Equação da formação da água a partir de íons
Nesse exemplo, teremos o deslocamento do equilíbrio iônico para a esquerda, já que os íons H+ são consumidos pelos ânions OH-, ocorrendo a prevalência da coloração amarela. Isso ocorre porque, segundo o princípio de Le Chatelier, quando um componente do equilíbrio tem a sua concentração diminuída, imediatamente o equilíbrio desloca-se no sentido de formar a substância ou íon consumido.
Resultado do deslocamento do equilíbrio após adição de Ca(OH)2

