Cálcio (Ca)
O cálcio é um metal alcalinoterroso, de número atômico 20, pertencente ao grupo 2 da tabela periódica. É sólido em temperatura ambiente, tem coloração prateada e é moderadamente macio. É o quinto elemento em abundância na crosta terrestre e um dos elementos mais abundantes nos organismos vivos. Assim como outros metais do seu grupo, é reativo com água e ao ar atmosférico. Possui seis isótopos naturais, sendo o isótopo 40Ca o de maior ocorrência.
Na natureza, é encontrado principalmente sob a forma de carbonato de cálcio. O cálcio puro possui poucas aplicações industriais. Já os seus compostos são amplamente empregados, sendo a fabricação do cimento a maior fonte de consumo desse elemento.
Na agricultura, o calcário é usado com frequência no procedimento conhecido como calagem, que visa equilibrar a acidez dos solos. No organismo, o cálcio é matéria-prima para os ossos e os dentes, participando também de outros processos, como a contração muscular e a coagulação sanguínea.
Leia também: Manganês — outro elemento químico essencial ao ser humano
Resumo sobre cálcio
-
O cálcio (Ca) é um metal alcalinoterroso pertencente ao grupo 2 da tabela periódica com número atômico 20.
-
O cálcio se oxida com facilidade no ar atmosférico.
-
É o quinto elemento mais abundante da crosta terrestre.
-
No corpo humano, é um dos elementos em maior concentração, responsável pela formação de ossos e dentes.
-
O cálcio é muito abundante na natureza, existindo sob a forma de diferentes minerais, sendo a calcita o de maior ocorrência.
-
Na indústria, é pouco utilizado sob a sua forma pura.
-
Os compostos de cálcio têm ampla aplicação industrial, agrícola, farmacêutica e nutricional.
-
A fabricação do cimento é a principal atividade consumidora de compostos de cálcio.
-
Foi identificado pela primeira vez em 1808 e isolado pela técnica de eletrólise ígnea.
Propriedades do cálcio
-
Símbolo: Ca.
-
Número atômico: 20.
-
Massa atômica: 40,078 u.m.a.
-
Configuração eletrônica: [Ar] 4s2.
-
Estado físico: sólido (a 20 °C).
-
Ponto de fusão: 842 °C.
-
Ponto de ebulição: 1484 °C.
-
Densidade: 1,54 g/cm3.
-
Eletronegatividade: 1,0 (escala de Pauling).
-
Série química: elementos representativos.
-
Localização na tabela periódica: grupo 2, período 4, bloco s.
-
Isótopos:
-
40Ca (96,9%);
-
42Ca (0,65%);
-
43Ca (0,14%);
-
44Ca (2,09%);
-
46Ca (0,004%);
-
48Ca (0,19%).
-
Características do cálcio
O cálcio é um elemento químico pertencente ao grupo 2 da tabela periódica, conhecido como família dos metais alcalinoterrosos. Possui aparência prateada e característica dúctil, assim como outros metais. É relativamente macio, podendo até mesmo ser cortado por uma faca, com determinado esforço.
De acordo com sua configuração eletrônica, o cálcio possui dois elétrons de valência, os quais podem ser perdidos, originando íons divalentes. Assim como os demais elementos do grupo 2, possui expressiva reatividade, manifestada quando entra em contato com o ar atmosférico, sendo prontamente oxidado e formando uma camada escura de óxido nitreto.

O cálcio também reage com água espontaneamente, formando óxido de cálcio e gás hidrogênio. Ao ser queimado, forma o óxido de cálcio (CaO), gerando uma chama amarelo-avermelhada. Possui propriedades similares às dos elementos bário e estrôncio, localizados no mesmo grupo da tabela periódica, logo abaixo do cálcio.
O elemento possui seis isótopos naturais: 40Ca, 42Ca, 43Ca, 44Ca, 46Ca e 48Ca. Desses, destacam-se o isótopo 40Ca por ser o mais abundante ― com aproximadamente 97% de ocorrência ― e o isótopo 48Ca, em razão do seu tempo de meia-vida extremamente alto, de cerca de 4,3 x 1019 anos. Os demais são de baixa ocorrência e raramente encontrados.
O cálcio é o quinto elemento mais abundante na crosta terrestre, compondo cerca de 3,6% desta e é o terceiro metal em abundância, ficando atrás apenas do ferro e do alumínio. Possui grande importância biológica, sendo um dos elementos metálicos mais abundantes no organismo humano.
Na natureza, o cálcio não é encontrado sob a sua forma pura, mas está amplamente presente na composição de muitos compostos químicos. O carbonato de cálcio (CaCO3) é o mineral de cálcio mais comum no planeta, sendo um dos principais constituintes de fósseis, mármores, calcário, conchas, corais, pérolas, carapaças de animais marinhos e casca de ovos.
Esse mineral pode existir sob diferentes arranjos estruturais, de onde derivam os nomes calcita, aragonita e dolomita. A extração de carbonato de cálcio no Brasil é distribuída ao longo de todo o país, sendo as regiões Centro-Oeste e Sul as responsáveis pela maior parte da produção nacional.
As reservas ou depósitos de carbonato de cálcio (CaCO3) se dissolvem em água acidificada pela presença de dióxido de carbono, formando o bicarbonato de cálcio (Ca(HCO3)2), de acordo com a reação expressa abaixo:
![]()
A existência desse equilíbrio químico é um dos principais mecanismos responsáveis pela formação de cavernas e por formações rochosas conhecidas como estalactites e estalagmites.

Devido à elevada abundância do cálcio, uma grande diversidade de minerais contendo esse elemento ocorre na natureza, além da forma carbonática (CaCO3), como a fluorita (CaF2), os feldspatos, os silicatos e os aluminosilicatos. O sulfato de cálcio também é um mineral abundante na natureza, sendo encontrado sob a forma de anidrita (CaSO4) e gipsita (CaSO4 ‧ 2H2O). O cálcio também está presente em depósitos de sal e em águas naturais, doces e salgadas.
O cálcio pode formar diferentes compostos com o ânion fosfato (PO43-). Dentre eles, destaca-se o hidroxifosfato de cálcio (Ca10(PO4)6(OH)2) ou hidroxiapatita, que em razão da baixíssima solubilidade é um dos constituintes naturais de ossos e dentes, compondo de 30 a 70% em massa dessas estruturas, de modo que os ossos e dentes são uma reserva de cálcio e de fósforo em organismos vivos.
A hidroapatita sintética (produzida artificialmente) é biocompatível e, por isso, muito utilizada em implantes dentários, próteses ortopédicas, procedimentos para reconstrução óssea, medicamentos e produtos de higiene bucal.
Para que serve o cálcio?
Em razão da elevada reatividade do cálcio em seu estado puro, ele possui aplicações limitadas na indústria, sendo mais seguro e viável utilizá-lo quando advindo de seus compostos derivados.
Dentre as aplicações em que o cálcio puro é utilizado está a fabricação do aço. Nesse procedimento, o cálcio é adicionado à liga metálica, se combinando com o oxigênio e o enxofre para formar óxidos e sulfetos, os quais melhoram as propriedades mecânicas do aço, como o lingotamento.
O cálcio puro tem aplicação na fabricação de baterias automotivas, junto do chumbo. Esses dois elementos combinados dão origem a uma liga metálica com capacidade de melhorar a eficiência e a vida útil da bateria.
Além da suplementação, no setor alimentício e farmacêutico, o emprego dos compostos derivados de cálcio é muito amplo no setor industrial, destacando-se alguns usos, tais como
-
sulfito de cálcio (CaSO3): alvejantes e branqueador na fabricação do papel e agente de limpeza desinfetante.
-
silicato de cálcio (Ca2SiO4): aditivos na fabricação de borrachas.
-
acetato de cálcio ((CH3CO2)2Ca): fabricação de sabões.
No setor de construção civil, o cálcio é um dos elementos químicos mais importantes, pois é um dos principais constituintes do cimento. Hoje, o cimento Portland é o tipo de cimento mais empregado mundialmente, preparado com uma mistura entre calcário (CaCO3) e argila, os quais são queimados e moídos, originando um pó fino que endurece em contato com a água. No preparo do cimento, também é comum a adição de gipsita, outro composto de cálcio, cuja função é tornar o endurecimento do cimento mais lento.

No setor agrícola, o calcário (CaCO3) e cal virgem (CaO) são extensamente utilizados no processo de calagem dos solos, que é uma prática que visa à redução da acidez do solo e ao fornecimento de cálcio e magnésio às plantas, nutrientes importantes ao seu crescimento.
Cálcio e a saúde
O cálcio é o mineral de maior abundância no corpo humano e possui importante função biológica, participando de muitos processos celulares. Uma das suas principais funções é a formação da estrutura esquelética, sendo que quase a totalidade do cálcio presente no corpo humano está nos ossos e dentes.
Sob a forma de íons cálcio (Ca2+), ele participa de processos fisiológicos e bioquímicos importantes, como a contração muscular, coagulação sanguínea, regulação da pressão arterial, liberação de neurotransmissores e processos enzimáticos. Além disso, tem especial papel no processo de fertilização. Os íons cálcio também estão envolvidos na formação das proteínas e na regeneração óssea.
Saiba também: Potássio — outro elemento químico que atua na contração muscular
Alimentos ricos em cálcio
Como o cálcio é um nutriente importante para o funcionamento adequado do organismo, deve-se manter atenção para manter a dieta equilibrada e consumir diariamente alimentos ricos em cálcio. Assim, a recomendação de ingestão diária é de cerca de 1000 mg, a qual deve ser aumentada para crianças, lactantes e gestantes.
A absorção do cálcio pelo organismo se torna mais eficiente quando ingerido em refeições sem cafeína ou sem alimentos ricos em ferro. A oferta adequada de vitamina D no organismo também contribui para melhor absorção do cálcio.

O cálcio pode ser encontrado em uma diversidade de alimentos, mas em diferentes quantidades. As fontes alimentares mais ricas desse elemento são os derivados do leite, peixes e frutos do mar, as nozes, amêndoas e amendoins, as sementes de gergelim e linhaça e os vegetais verde-escuros como o espinafre, a couve e o brócolis.
A tabela abaixo|1| reúne alguns alimentos ricos em cálcio e a quantidade desse elemento por porção de 100g.
|
Alimento |
Quantidade de cálcio / mg |
|
Leite de vaca integral |
890 |
|
Queijo muçarela |
875 |
|
Gergelim |
825 |
|
Sardinha em conserva |
550 |
|
Amêndoas |
237 |
|
Couve |
177 |
|
Agrião |
133 |
|
Espinafre |
112 |
|
Ovo cozido (gema) |
114 |
|
Brócolis |
86 |
Precauções com o cálcio
A principal precaução que se deve ter em relação ao cálcio é quanto à sua ingestão em quantidades adequadas.
A deficiência de cálcio é prejudicial. Como esse elemento é essencial ao funcionamento do organismo, quando a sua concentração na corrente sanguínea diminui em razão de má alimentação ou disfunções hormonais, o corpo busca repor a deficiência retirando o cálcio armazenado nos ossos.
Quando esse mecanismo de reposição ocorre de forma recorrente, é comum o desenvolvimento de osteopenia e osteoporose, que tornam os ossos porosos e mais fracos, aumentando a incidência de fraturas.
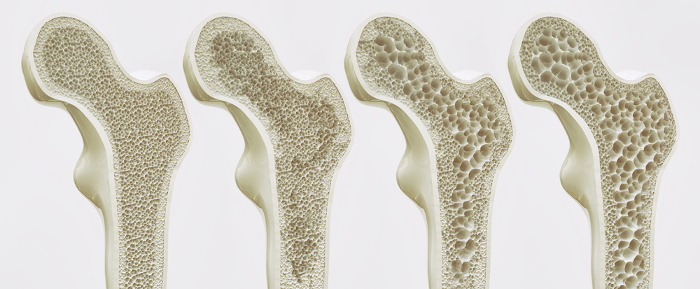
A deficiência de cálcio também pode contribuir para unhas quebradiças, dentes mais suscetíveis às cáries, hipertensão e distúrbios como insônia, depressão e irritabilidade.
Por outro lado, o excesso de cálcio no organismo também é prejudicial, podendo contribuir para a formação dos cálculos renais, que são as conhecidas “pedras nos rins”, as quais são compostas por oxalato de cálcio. O excesso de cálcio no corpo pode interferir na absorção e armazenamento de outros nutrientes, como o magnésio.
Obtenção do cálcio
O primeiro registro de obtenção do cálcio em sua forma pura data de 1808, quando foi aplicado o método de eletrólise ígnea a uma mistura entre óxidos de cálcio e de mercúrio. Usando essa mesma técnica, o cálcio também pode ser isolado usando cloreto de cálcio (CaCl2) fundido. Atualmente, o cálcio metálico é obtido em escala industrial por meio do aquecimento do calcário (CaCO3), processo denominado calcinação. Observe:
![]()
Nesse método, dióxido de carbono é liberado como gás, ficando como produto principal o óxido de cálcio (CaO), conhecido como cal viva.
História do cálcio
Em razão de minerais de cálcio serem comuns na natureza, seus compostos já eram conhecidos pelos povos mais antigos. Existem registros da utilização da cal para a construção de casas e de gesso na confecção de estátuas em cerca de 7000 a.C., na região da Mesopotâmia, que corresponde aos territórios do Irã, Iraque e Jordânia.
As pirâmides do Egito foram construídas utilizando sulfato de cálcio (CaSO4). Os antigos romanos também empregavam massas formadas por carbonato de cálcio como cimento para levantar construções.
No entanto, apenas no início do século XIX o elemento foi isolado sob a sua forma pura. Para isso, o químico inglês Humphry Davy aplicou o método de eletrólise usando mistura entre óxidos de cálcio e de mercúrio, utilizando eletrodos de platina como ânodo, sobre o qual ocorreu a formação de uma amálgama de mercúrio-cálcio. Na sequência, a separação da amálgama foi realizada por destilação, removendo-se o mercúrio e sendo obtido o cálcio em sua forma pura.
Notas
|1| NÚCLEO DE ESTUDOS E PESQUISAS EM ALIMENTAÇÃO. Tabela brasileira de composição de alimentos. 4. ed. Campinas: Unicamp, 2011. 161 p. Disponível aqui.

