Potássio (K)
O potássio (K) é um metal alcalino pertencente ao grupo 1 da tabela periódica, possui número atômico 19, é sólido em temperatura ambiente e é muito macio. Trata-se do oitavo elemento mais abundante da crosta terrestre, encontrado em minerais e em águas salgadas.
Esse elemento é facilmente oxidado pelo oxigênio atmosférico e é extremamente reativo com água, podendo gerar explosões. Na natureza, existe sob a forma de três isótopos, sendo um deles radioativo.
A principal demanda do potássio é na fabricação de fertilizantes agrícolas, consumindo cerca de 95% de toda a extração mundial. Esse elemento atua no fortalecimento e resistência das plantas. Compostos contendo potássio também podem ser utilizados na fabricação de explosivos e de fogos de artifício e na indústria têxtil e alimentícia.
O potássio é um nutriente essencial para os animais, atuando nos processos de contração muscular, transmissão de impulsos nervosos e equilíbrio fisiológico. Verduras, legumes, feijões e laticínios são alimentos ricos em potássio.
Leia também: Selênio — outro elemento essencial para a saúde humana
Resumo sobre o potássio
-
O potássio (K) é um metal alcalino pertence ao grupo 1 da tabela periódica com número atômico 19.
-
É facilmente oxidado pelo gás oxigênio e reage violentamente com água.
-
Está entre os dez elementos mais abundantes da crosta terrestre.
-
É encontrado em maior quantidade no mineral silvita (KCl).
-
Pode ser obtido sob a forma de potássio metálico por eletrólise ígnea.
-
Foi identificado pela primeira vez em 1807, pelo químico britânico Humphty Davy.
-
É um nutriente essencial para as plantas e para os animais.
-
Sua principal aplicação é na composição dos fertilizantes.
-
Possui aplicações na indústria alimentícia e têxtil, na fabricação de explosivos, fogos de artifício, entre outras.
-
Na saúde animal e humana, é um nutriente essencial que contribui para o equilíbrio fisiológico, transporte de nutrientes e estrutura arterial.
Propriedades do potássio
-
Símbolo: K.
-
Número atômico: 19.
-
Massa atômica: 39,098 u.
-
Configuração eletrônica: [Ar] 4s1.
-
Estado físico: sólido (20 °C).
-
Ponto de fusão: 63,5 °C.
-
Ponto de ebulição: 759 °C.
-
Densidade: 0,89 g/cm3.
-
Eletronegatividade: 0,82 (escala de Pauling).
-
Série química: elementos representativos.
-
Localização na tabela periódica: grupo 1 (metal alcalino), período 4, bloco s.
-
Isótopos naturais: 39K (93,2581%), 40K (0,0117%), 41K (6,7302%).
Características do potássio
O potássio é um metal alcalino pertencente ao grupo 1 da tabela periódica, sendo o segundo metal mais leve conhecido, perdendo apenas para o lítio.
À temperatura ambiente (20 °C), o potássio é sólido e tem aspecto macio, podendo ser cortado com uma faca. Possui coloração branco-prateada, mas é imediatamente oxidado quando exposto à atmosfera, adquirindo coloração acinzentada. Por isso, seu armazenamento é feito por imersão em querosene ou óleo mineral, evitando qualquer tipo de exposição ao oxigênio e à umidade.
Assim como outros metais alcalinos, reage violentamente com água em uma reação de decomposição, liberando gás hidrogênio (H2) e alta quantidade de calor (reação exotérmica). Em razão da característica inflamável do H2 e da alta temperatura que essa reação pode alcançar, o gás H2 pode entrar em ignição e explodir. Por isso, o contato do potássio metálico com a água deve ser evitado ao máximo.
\(2K(s)+2H_2O(l)\rightarrow2KOH(aq)+H_2(g)\)

O potássio reage de forma rápida com os ácidos e com os não-metais, como o nitrogênio, o cloro, o fósforo e o enxofre. A característica de alta reatividade desse elemento se deve à sua baixa energia de ionização, isto é, a quantidade de energia necessária para remover um elétron do átomo.
Em razão da alta reatividade, o potássio nunca é encontrado na sua forma pura na natureza, mas ocorre combinado a outros elementos químicos, sob a forma de diferentes compostos, os quais são bastante numerosos. Alguns dos principais minerais que contêm potássio são a silvita e a carnalita. Em termos de quantidade, o potássio é o oitavo elemento mais abundante na crosta terrestre, representando 2,4% do total.
Quando exposto ao calor do fogo, o potássio forma chamas de coloração violeta, em razão dos processos de excitação eletrônica. Por isso, sais de potássio são utilizados na composição de fogos de artifício.
O potássio possui 25 isótopos conhecidos, no entanto, apenas três desses ocorrem de forma natural. As espécies 39K e 41K são isótopos estáveis e possuem as maiores abundâncias relativas, de 93,258% e 6,730%, respectivamente. A espécie 40K está presente em quantidade baixa (cerca de 0,0117%) e apresenta decaimento radioativo com tempo de meia-vida de 1,250·109 anos. Em razão desse longo tempo de meia-vida, o isótopo 40K é utilizado em sistemas de datação de minerais.
Para que serve o potássio?
O potássio é um elemento de ampla aplicação na indústria e importante papel na saúde humana e animal. No setor industrial, os fertilizantes consomem mais de 95% do potássio produzido mundialmente, e esse número tende a aumentar. Com o crescimento da população mundial, maior quantidade de fertilizante é requerida para elevar e melhorar a produção agrícola.
Os nutrientes essenciais de que os vegetais necessitam são obtidos dos solos. A função dos fertilizantes é repor os minerais que foram utilizados pelas plantas durante seu ciclo de cultivo, mantendo os níveis adequados de nutrientes durante o processo de crescimento e preparando o solo para um novo ciclo.
Nitrogênio, fósforo e potássio compõem o trio NPK e são os macronutrientes presentes em fertilizantes comerciais. Cada um desses elementos desempenha uma função específica para a saúde das plantas. O potássio auxilia no fortalecimento e resistência da plantação às doenças, sendo importante para o aumento do rendimento agrícola. Além disso, contribui para o processo de regulação da água nos vegetais, fortalecendo o sistema radicular, ajudando a planta a lidar com alterações de temperatura.

Nos fertilizantes, o potássio se apresenta ligado a cloretos, nitratos e sulfatos, os quais são solúveis em água. Quando entram em contato com o solo, liberam os íons K+, os quais interagem com a porção de carga negativa das partículas de solo, ficando disponíveis para absorção pelas raízes das plantas.
As principais fontes de potássio utilizadas nos fertilizantes são os sais cloreto de potássio (KCl), sulfato de potássio (K2SO4), sulfato duplo de potássio e magnésio (K2SO4‧2MgSO4) e nitrato de potássio (KNO3), os quais fornecem potássio em diferentes proporções. A fonte de potássio mais adequada para cada aplicação depende das necessidades da planta, das condições do solo e dos fatores climáticos.
O Brasil é o maior importador de potássio do mundo, tendo adquirido 10,45 milhões de toneladas em 2019. Atualmente, o país importa 96,5% do cloreto de potássio que utiliza como fertilizantes. Canadá, Rússia e China são os principais países produtores de potássio.
No Brasil, existem minas de extração de potássio em Sergipe e no Amazonas. As reservas de silvinita mais importantes estão localizadas na região de Taquari/Vassouras e Santa Rosa de Lima, em Sergipe. Por dificuldades de extração, uma pequena porção do potássio consumido no país vem de fontes nacionais.
O cloreto de potássio, além de ser extensamente aplicado à composição dos fertilizantes, também é importante matéria prima para outros sais de potássio, como o hidróxido de potássio (KOH) e o iodeto de potássio. O KOH é empregado na fabricação de sabões e detergentes, como eletrólito em baterias e células a combustível, como agente branqueador, entre outras aplicações. O KI é adicionado ao sal de cozinha, suplementos alimentares e rações animais, a fim de diminuir a deficiência de iodo.
O nitrato de potássio (KNO3) ou salitre é utilizado na fabricação de fogos de artifício, de explosivos, como propelente em combustível de aeronaves espaciais, na conservação de alimentos (principalmente os embutidos, como linguiças) e em fertilizantes. O sal cromato de potássio (K2CrO4) tem uso na indústria têxtil, sendo aplicado no tingimento de tecidos e no processo de curtimento do couro.
Em usinas nucleares, o potássio metálico é empregado como resfriador dos reatores nucleares. Sua função é absorver o calor do núcleo do reator. Então, por meio de tubulações, o potássio líquido flui para uma câmara onde é resfriado, transferindo o calor absorvido para uma caldeira com água. Nesse segundo processo de transferência de calor, a água entra em ebulição, gerando vapor de água, o qual é aproveitado na operação de equipamentos para geração de eletricidade.
Leia também: Qual é o elemento mais abundante do Universo?
Obtenção do potássio
Sendo um dos elementos mais abundantes da Terra, o potássio está bem distribuído ao redor do planeta. Contudo, em razão da extrema reatividade com água e afinidade com outros elementos químicos, o potássio não é encontrado em sua forma pura na natureza, mas ocorre sob a forma de compostos químicos. O potássio é encontrado em oceanos, lagos, solos, rochas, minerais e salinas formadas pela evaporação de antigos mares. Dessas fontes são extraídos cerca de 35 milhões de toneladas anualmente.
Apesar de potássio também ser encontrado em rochas ígneas, como em feldspatos, esse não é seu principal meio de obtenção, em razão da baixa solubilidade em água. Por outro lado, o potássio disponível em depósitos formados por processos de evaporação são as fontes mais significativas desse elemento, por causa da maior facilidade de acesso advinda da maior solubilidade em água.
Os principais minerais fontes de potássio são:
-
silvita (KCl) — 63%;
-
carnalita (KCl‧MgCl2‧6H2O) — 17%;
-
cainita (KCl‧MgSO4‧3H2O) — 19%;
-
langbeinita (K2SO4‧2MgSO4) — 23%;
-
polialita (K2Ca2Mg(SO4)4‧2 H2O) — 15,6%;
-
schoenita (K2SO4‧MgSO4‧6H2O) — 23,4%;
-
singernita (K2SO4‧CaSO4‧H2O) — 28%.
Obs.: Dados de porcentagem em termos de K2O.

Fontes de potassa cáustica (hidróxido de potássio — KOH) existem na Alemanha e Estados Unidos. O oceano também contém quantidades significativas de potássio, mas em menor proporção se comparada aos sais de sódio. Aproximadamente 90% do potássio obtido desses minerais está sob a forma de cloreto de potássio, e cerca de 5%, associado ao sulfato.
A obtenção do potássio advindo dos minerais descritos acima pode ser realizada por eletrólise, que é a mesma técnica que Humphty Davy utilizou para descobrir esse metal em 1807, mas aplicada em escala industrial.
A eletrólise ígnea é executada na ausência total de água ou de soluções aquosas, e no procedimento para obter o potássio, normalmente é usado cloreto de potássio como eletrólito. Esse sal é aquecido acima de seu ponto de fusão, obtendo-se o KCl fundido, que é uma massa líquida contendo íons potássio (K+) e íons cloreto (Cl-).
Dois eletrodos metálicos são imersos no KCl fundido e atuam como cátodo e ânodo. Ao ligar esses dois eletrodos a uma fonte de energia, ocorre oxirredução, reduzindo os íons K+ a potássio metálico no cátodo e oxidando os íons Cl- a gás cloro (Cl2) no ânodo.
O hidróxido de potássio também pode atuar como eletrólito na eletrólise. Atualmente, o KCl é o sal mais utilizado na aplicação da técnica de eletrólise para obtenção de potássio.
Alimentos ricos em potássio
O potássio é um elemento essencial ao adequado funcionamento do corpo humano, possuindo diversas funções, sendo uma das principais a manutenção do nível apropriado de fluido dentro das células.
Há uma recomendação geral de que a ingestão média diária de potássio deve ser de aproximadamente 2.320 mg para mulheres e de 3.016 mg para homens, podendo esses valores ser alterados, a depender de condições específicas, como gravidez.
O potássio é um mineral abundante nos alimentos, especialmente em vegetais e frutas. As folhas verdes, os legumes, outras verduras, os feijões e os laticínios são ricas fontes desse elemento.

A tabela abaixo indica os valores médios de potássio encontrados em alguns alimentos, considerando porções de uma xícara. Além desses, existe uma infinidade de outros alimentos ricos em potássio.
|
Alimento |
Quantidade de potássio / mg |
|
Folhas de beterraba (cozidas) |
1309 |
|
Feijão cozido |
969 |
|
Acelga |
961 |
|
Batata |
926 |
|
Inhame |
911 |
|
Espinafre |
839 |
|
Abóbora |
896 |
|
Brócolis |
550 |
|
Abacate |
364 |
|
Banana |
451 |
|
Água de coco |
396 |
|
Iogurte |
625 (em 227 g) |
|
Leites lácteos e leites vegetais |
382 |
|
Jaca |
739 |
|
Goiaba |
688 |
|
Graviola |
626 |
|
Kiwi |
562 |
|
Mexilhão |
534 |
|
Atum |
444 |
|
Tilápia |
323 |
|
Salmão |
280-535 |
FONTE: Current Dietary Guidelines.
É uma ideia popular indicar o consumo de banana para evitar ocorrência de cãibras musculares, com a justificativa de esse alimento ser rico em potássio. Essa indicação é importante, no entanto, pela tabela acima é possível verificar que existem muitos outros alimentos que podem ser importantes fontes desse mineral.
Potássio na saúde
O potássio é um dos nutrientes essenciais aos seres vivos. Esse elemento permite que nervos respondam aos estímulos e que os músculos sejam contraídos, inclusive o coração. Potássio participa da movimentação de nutrientes e produtos residuais para dentro e fora das células e tem função na sustentação do sistema arterial.
O sódio (Na) e o potássio têm funções complementares dentro do organismo, atuando de formas opostas. Ambos mantêm o equilíbrio fisiológico, contribuindo para a homeostase. Doenças crônicas, como as doenças cardiovasculares, podem ter origem no desequilíbrio entre esses nutrientes.
Por exemplo, o alto consumo de cloreto de sódio contribui para o aumento da pressão arterial, fator que pode desencadear doenças do coração. Por outro lado, o adequado consumo de potássio reduz a pressão nas artérias, pelo efeito de relaxamento dos vasos sanguíneos, e aumenta a taxa de excreção do sódio.
Um dos processos mais importantes para o equilíbrio corporal é conhecido como bomba de sódio e potássio, que é um mecanismo de transporte de substâncias para dentro e fora da célula.
Dentro das células há uma quantidade de íons potássio muito maior do que fora delas. O oposto ocorre para os íons sódio, que estão presentes em maior quantidade fora da célula. Isso constitui um gradiente de concentração (diferença de concentração) entre o sódio e potássio na membrana plasmática, que é fundamental para que o metabolismo celular seja executado.
Como esses íons conseguem atravessar a membrana plasmática por difusão, eles se movem naturalmente em direção ao meio que está menos concentrado. No entanto, a diferença de concentração entre íons sódio e potássio dentro e fora da célula precisa ser mantida, e esse trabalho é executado pelo mecanismo da bomba de sódio e potássio. Proteínas presentes na membrana plasmática assumem o papel de restabelecimento da diferença de concentração entre íons K+/Na+. Essas proteínas capturam o potássio que está fora da célula e bombeiam para fora o sódio que está dentro da célula.
Esse processo ocorre a todo instante no organismo humano e é fundamental para que os impulsos nervosos e a contração dos músculos aconteçam.
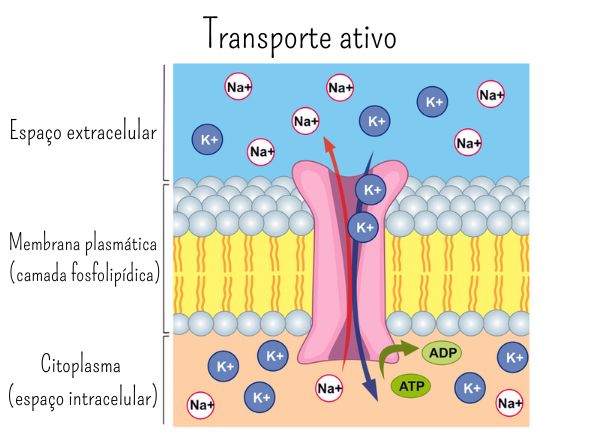
Os rins controlam os níveis de potássio no organismo, removendo o excesso pela urina. No caso de os rins não funcionarem adequadamente, talvez haja excesso de potássio na corrente sanguínea, podendo alterar o ritmo da batida do coração e ocorrer até mesmo parada cardíaca.
Naturalmente, o corpo humano possui maior demanda por potássio do que por sódio. No entanto, a dieta de grande parte da população é constituída por altas concentrações diárias de sódio, por causa do consumo exagerado de produtos alimentícios ultraprocessados.
É importante para a saúde manter uma proporção adequada na ingestão de sódio e de potássio. Pessoas que mantêm uma dieta rica em sódio e deficiente em potássio têm o dobro de chance de sofrerem ataques cardíacos em comparação a indivíduos que mantêm valores adequados de consumo desses nutrientes.
O equilíbrio na proporção de consumo entre esses dois nutrientes pode ser obtido por meio de uma alteração na dieta, aumentando a quantidade de vegetais e frutas e reduzindo pães, queijos e carnes processadas.
Leia também: Riscos do excesso de sal na alimentação
História do potássio
O potássio foi identificado pela primeira vez em 1807, pelo químico britânico Humphty Davy, que observou a presença de uma pequena gota de metal líquido após a eletrólise do hidróxido de potássio (KOH) fundido. O potássio foi o primeiro elemento metálico isolado por meio de eletrólise.
O termo “potássio” deriva do termo em inglês potash, que se refere ao conjunto de sais que contêm o elemento potássio em forma solúvel em água e que servem de matéria-prima para a indústria. O termo potash significa “panela de cinzas” em português, em alusão ao processo de obtenção do potássio antes da Era Industrial.

