Fórmulas das bases
As bases, segundo Arrhenius, são substâncias que, na presença de água, dissociam-se e liberam dois íons: um cátion qualquer (Y+x) e um ânion hidróxido (OH-1), como na representação a seguir:
![]()
A fórmula padrão da base, demonstrada acima, sempre apresenta o elemento metálico à esquerda do grupo hidróxido. O valor de x depende da carga do cátion formado pelo elemento metálico.
Obs.: Existe apenas uma base em que o componente Y não é um metal, que é o hidróxido de amônio.
O conhecimento da fórmula de uma base é importante para diversos fins:
-
Construção da nomenclatura;
Não pare agora... Tem mais depois da publicidade ;) -
Construção da equação de dissociação;
-
Determinação da solubilidade;
-
Determinação da força.
Construção da fórmula das bases segundo o conceito de íon-fórmula
Como as bases são formadas por ligação iônica, em virtude da presença de um metal com o grupo hidróxido, a montagem da fórmula desse composto segue o padrão de construção de um íon-fórmula (referente aos compostos iônicos).
Para montar um íon-fórmula, devemos fazer o seguinte:
-
Sigla do metal ou cátion à esquerda;
-
Sigla do ânion à direita.
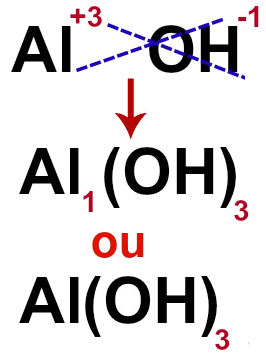
Por fim, basta cruzar as cargas de cada um dos componentes para que elas se transformem na quantidade de átomos de cada um.
A fórmula da base que apresenta o cátion alumínio (Al+3) e o ânion hidróxido (OH-1), por exemplo, é:
Construção de fórmulas a partir dos nomes das bases
O nome de uma base Arrhenius segue esta regra de nomenclatura:
Hidróxido + de + nome do elemento
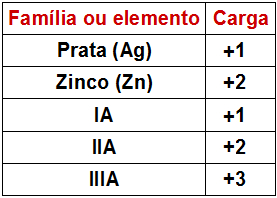
Se o elemento presente na base não for a prata e o zinco ou não pertencer às famílias IA, IIA e IIIA, sempre virá escrito um algarismo romano (correspondente à carga do cátion formado pelo elemento) com o nome do elemento.
Para construir a fórmula da base a partir do nome, devemos fazer o seguinte:
-
Iniciar a fórmula com a sigla referente ao nome do elemento;
-
Em seguida, escrever o grupo OH, referente ao termo hidróxido;
-
Por fim, escrever o número no lugar de x (presente na fórmula geral), o qual corresponde à carga do cátion formado pelo elemento.
O hidróxido de titânio II, por exemplo, apresenta fórmula Ti(OH)2, já que:
-
Ti é a sigla do elemento titânio;
-
OH é o ânion de toda base;
-
2 é a carga do cátion titânio indicada no nome.
Se no nome da base não houver nenhum algarismo após o nome do elemento, a carga do cátion desse elemento seguirá este padrão:
Utilização da fórmula para construção do nome da base
Quando um texto ou um exercício fornece a fórmula de uma base, podemos construir seu nome de acordo com o raciocínio a seguir:
-
O nome inicia-se com hidróxido porque a regra de nomenclatura assim determina;
-
Em seguida, coloca-se a preposição de;
-
Por fim, inserimos o nome do elemento cuja sigla está na fórmula fornecida.
A base de fórmula Sb(OH)3, por exemplo, é chamada de hidróxido de antimônio III, pois:
-
Hidróxido é o início do nome de toda base;
-
Antimônio é o nome do elemento de sigla Sb;
-
III é o número referente à carga do cátion desse elemento.
Exemplos de construção de fórmulas de bases
→ Hidróxido de ferro III
A partir do nome fornecido, temos que:
-
Fe é a sigla do elemento ferro;
-
OH é o ânion de toda base;
-
III refere-se à carga do cátion ferro indicada no nome.
A fórmula dessa base é Fe(OH)3.
→ Hidróxido de prata
A partir do nome fornecido, temos que:
-
Ag é a sigla do elemento prata;
-
OH é o ânion de toda base;
-
I refere-se à carga do cátion prata.
A fórmula dessa base é AgOH.
→ Hidróxido de magnésio
A partir do nome fornecido, temos que:
-
Mg é a sigla do elemento magnésio;
-
OH é o ânion de toda base;
-
II refere-se à carga do cátion magnésio.
A fórmula dessa base é Mg(OH)2.
→ Hidróxido de cobre II
A partir do nome fornecido, temos que:
-
Cu é a sigla do elemento cobre;
-
OH é o ânion de toda base;
-
II refere-se à carga do cátion cobre indicada no nome.
A fórmula dessa base é Cu(OH)2.