Número atômico
O número atômico (Z) é o número de prótons existentes no núcleo de um átomo, sendo a propriedade que define os elementos químicos. Não existem elementos diferentes com a mesma quantidade de prótons. Por isso, na Tabela Periódica, os elementos químicos são organizados em sentido crescente de número atômico e expressos normalmente do lado esquerdo do símbolo do elemento.
O valor de número atômico para um átomo pode ser conhecido por meio da sua quantidade de prótons ou da quantidade de elétrons. Afinal, quando o átomo está em seu estado neutro, a quantidade de prótons e de elétrons é a mesma.
Leia também: Atomística — os principais conceitos relacionados ao estudo do átomo
Resumo sobre o número atômico
-
O número atômico é a quantidade de prótons no núcleo do átomo, representada pela letra Z.
-
Os elementos químicos são definidos pelo seu número atômico.
-
Não existem elementos químicos diferentes que possuam o mesmo número atômico.
-
O número atômico é uma medida da carga elétrica positiva do átomo, útil para indicar a quantidade de elétrons em átomos neutros.
-
Em íons de um mesmo elemento, o número atômico não muda, altera-se apenas a quantidade de elétrons perdidos ou recebidos.
-
A Tabela Periódica é organizada em sentido crescente de números atômicos.
-
Na Tabela Periódica, o número atômico normalmente é expresso à esquerda do símbolo do elemento.
-
O número de massa é o somatório entre a quantidade de prótons e nêutrons.
-
A descoberta do número atômico ocorreu por meio do estudo das interações entre raios X e a matéria.
-
A partir dessa descoberta, a Tabela Periódica passou a ser ordenada pelo número atômico, e não mais pela massa atômica.
O que é número atômico?
O número atômico é o número de prótons existentes no núcleo de um átomo. Ele define a identidade do átomo.
Os elementos químicos são, portanto, definidos pelo seu número atômico. Por exemplo, qualquer átomo que possua número atômico igual a 7 será o nitrogênio, independentemente da sua quantidade de elétrons ou de nêutrons.
Não há a possibilidade de elementos diferentes possuírem o mesmo número atômico, pois quando dois átomos têm o mesmo número atômico, eles são exatamente o mesmo elemento químico.
Os prótons são as partículas subatômicas de carga elétrica positiva, por isso, o número atômico é uma medida da carga positiva presente no núcleo atômico.
Como os átomos são eletricamente neutros, a quantidade de prótons e de elétrons é igual. Dessa forma, conhecendo o número atômico de um elemento é possível determinar a quantidade de elétrons existentes na eletrosfera daquele átomo. É importante destacar que a letra Z é utilizada para representar o número atômico.
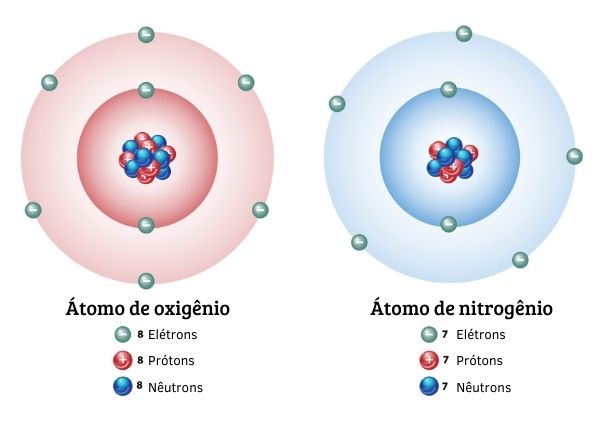
Como determinar o número atômico?
O número atômico equivale ao número de prótons no núcleo do átomo. Logo, ao saber a quantidade de prótons em um átomo, determina-se o valor de Z.
Por exemplo, o elemento cálcio possui em seu núcleo 20 prótons e 20 nêutrons. Logo, seu número atômico é igual a 20.
Uma segunda abordagem para encontrar o valor do número atômico é conhecer a quantidade de elétrons. Os átomos são eletricamente neutros e possuem a mesma quantidade de partículas com carga positiva e negativa, as quais chamamos de prótons e elétrons, respectivamente. Dessa forma, conhecendo a quantidade de elétrons em um átomo neutro, é possível saber a quantidade de prótons, que, por sua vez, determina o número atômico daquele elemento.
Veja o caso do elemento carbono, que possui 6 elétrons. Qual seria seu número atômico? Considerando que o átomo é eletricamente neutro, o elemento carbono deve possuir em seu núcleo 6 prótons, já que possui 6 elétrons. Então, seu número atômico é 6.
Os átomos podem perder ou receber elétrons de outros elementos químicos, formando íons positivos ou negativos. Nesses casos, o número de elétrons e de prótons no átomo não é mais igual. Por isso, deve-se ter cuidado ao determinar o número atômico de um íon por meio da quantidade de elétrons. Afinal, o que mudou foi apenas o número de elétrons, e não de prótons.
Veja um exemplo para o íon magnésio (Mg2+), que possui dez elétrons. Nesse caso, a formação de íon aconteceu pela perda de dois elétrons do átomo de magnésio. Isso significa que o átomo neutro de magnésio possui 12 elétrons, logo, tem 12 prótons, e seu número atômico é 12.
Leia também: Cálculos que envolvem semelhança atômica
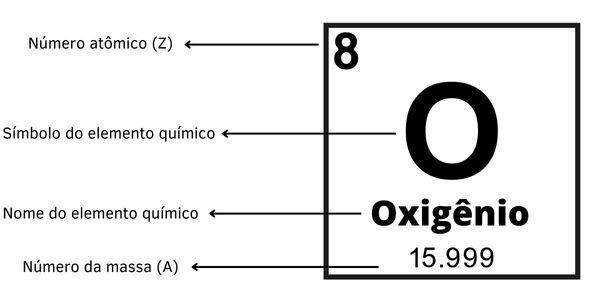
Como identificar o número atômico na Tabela Periódica?
Os elementos químicos são organizados na Tabela Periódica em sentido crescente de número atômico, começando pelo hidrogênio (Z = 1) e indo até o oganessônio (Z = 118).
Por isso, é fácil identificar os números atômicos de cada elemento na Tabela Periódica. Geralmente, o número atômico aparece ao lado esquerdo do símbolo do elemento. Veja:
Qual a importância do número atômico?
O número atômico caracteriza um elemento químico, sendo uma propriedade importante dos átomos, além de permitir a obtenção de outras informações sobre ele.
Essa propriedade define a posição de um elemento na Tabela Periódica. As propriedades periódicas variam de forma conhecida na tabela. Assim, ao conhecer o número atômico de um elemento, é possível prever a sua posição e, inclusive, suas propriedades periódicas e principais características.
O número atômico também é importante para a determinação da quantidade de elétrons na eletrosfera, uma vez que o número de elétrons e prótons é igual para átomos neutros.
Além disso, conhecendo o valor de Z é possível determinar a distribuição eletrônica do átomo, característica importante para a determinação da natureza das ligações químicas.
Junto do número de massa, conhecer o número atômico permite saber quantos nêutrons ― partículas subatômicas de carga zero ― existem no núcleo.
Diferenças entre número atômico e número de massa
O número atômico informa a quantidade de prótons em um átomo. O número de massa, representado por A, é o somatório do número de prótons e do número de nêutrons.
Número de massa (A) = número de prótons (Z) + número de nêutrons
Prótons e nêutrons são partículas subatômicas localizadas no núcleo e que definem a massa total do átomo, uma vez que os elétrons possuem massa insignificante.

Note que o número de massa sempre será superior ao número atômico.
Os isótopos de um elemento químico se diferenciam por diferentes números de massa (A), mantendo igual número atômico (Z). Afinal, se referem ao mesmo elemento químico, mas se diferenciam pela quantidade de nêutrons no núcleo.
Leia também: Diferença entre número de massa e massa atômica
Origem do número atômico
A compreensão sobre o número atômico foi essencial para fornecer uma base teórica que explicasse as propriedades periódicas dos elementos químicos na Tabela Periódica.
A Tabela Periódica foi proposta por Dmitri Mendeleev em 1860, que se baseou em observações experimentais e tinha um respaldo teórico ainda frágil.
Em 1895, as pesquisas com raios X, iniciadas por Wilhelm Röntgen, incentivou diversos estudos sobre a interação desse tipo de radiação com a matéria.
Em meados de 1903, o cientista inglês Charles Grover Barkla investigou a interação entre os raios X e os elementos gasosos, percebendo que a forma como a radiação era emitida se alterava conforme a posição que o elemento ocupava na Tabela Periódica.
Anos mais tarde, em 1913, o físico inglês Henry Moseley ampliou o conhecimento de Barkla para outros elementos químicos, também reconhecendo uma forte correlação de regularidade entre os espectros de raios X e a posição do elemento na tabela. Moseley propôs que tal comportamento regular estaria associado ao número de elétrons de cada elemento e, de certa forma, também com o número de prótons, uma vez que essas duas partículas subatômicas estão presentes em igual quantidade.

Com essa hipótese inicial, Moseley atribuiu valores numéricos aos elementos químicos de acordo com as mudanças regulares registradas em seus espectros de raios X. Com o amadurecimento de seus estudos, Moseley conseguiu definir que o número atômico, na realidade, reflete o número de prótons de um átomo.

Essa descoberta teve importante impacto sobre as leis periódicas propostas por Mendeleev, as quais eram explicadas inicialmente com base no número de massa. Ao determinar que as propriedades periódicas variam em função do número atômico (e não da massa atômica), algumas pequenas incongruências na tabela de Mendeleev puderam ser resolvidas.
Portanto, a descoberta do número atômico ocorreu durante experimentos de interação entre raios X e diferentes elementos químicos e levou a uma explicação teórica para as propriedades químicas periódicas, considerando a estrutura atômica dos átomos.
Com essas conclusões, a tabela periódica passou a ser ordenada em sentido crescente de números atômicos.
Exercícios resolvidos sobre o número atômico
Questão 1
(Udesc) Na Inglaterra, por volta de 1900, uma série de experimentos realizados por cientistas, como Sir Joseph John Thompson (1856-1940) e Ernest Rutherford (1871-1937), estabeleceu um modelo do átomo que serviu de base à teoria atômica. Atualmente, sabe-se que três partículas subatômicas são os constituintes de todos os átomos: prótons, nêutrons e elétrons. Dessa forma, o átomo constituído por 17 prótons, 18 nêutrons e 17 elétrons possui número atômico e número de massa, sequencialmente, iguais a:
a) 17 e 18
b) 34 e 52
c) 17 e 17
d) 17 e 35
e) 35 e 17
Resolução:
Letra D
O número atômico (Z) representa o número de prótons no núcleo. O número de massa (A) considera as partículas subatômicas que efetivamente contribuem para a massa do átomo, sendo o somatório entre prótons e nêutrons.
Sabendo disso, se um átomo possui 17 prótons, seu número atômico é 17. Se esse mesmo átomo possui no núcleo, além de 17 prótons, também 18 nêutrons, seu número de massa é 35 (17+18).
Questão 2
(Unesp 2004) Os “agentes de cor”, como o próprio nome sugere, são utilizados na indústria para a produção de cerâmicas e vidros coloridos. Tratam-se, em geral, de compostos de metais de transição, e a cor final depende, entre outros fatores, do estado de oxidação do metal, conforme mostram os exemplos na tabela a seguir.
|
Coloração |
Agente de cor |
Estado de oxidação |
Número atômico |
|
Verde |
Cr (crômio) |
Cr3+ |
24 |
|
Amarela |
Cr (crômio) |
Cr6+ |
24 |
|
Marrom-amarelada |
Fe (ferro) |
Fe3+ |
26 |
|
Verde-azulada |
Fe (ferro) |
Fe2+ |
26 |
|
Azul-clara |
Cu (cobre) |
Cu2+ |
29 |
Com base nas informações fornecidas na tabela, é correto afirmar que:
a) o número de prótons do cátion Fe2+ é igual a 24.
b) o número de elétrons do cátion Cu2+ é 29.
c) Fe2+ e Fe3+ não se referem ao mesmo elemento químico.
d) o cátion Cr3+ possui 21 elétrons.
e) no cátion Cr6+ o número de elétrons é igual ao número de prótons.
Resolução:
Letra D
O item A está incorreto. O número de prótons é o número atômico. De acordo com a tabela, o íon Fe2+ possui 26 prótons.
O item B está incorreto. O cobre possui número atômico 29, logo possui 29 prótons. Quando está em estado neutro (átomo), a quantidade de prótons e elétrons é a mesma. Ao formar o cátion Cu2+, o átomo de cobre perde dois elétrons, então, nessa configuração, continua possuindo 29 prótons, mas agora tem 27 elétrons.
O item C está incorreto. Os íons Fe2+ e Fe3+ se referem ao mesmo elemento químico, pois possuem o mesmo número atômico. O que os diferencia é a quantidade de elétrons.
O item D está correto. O átomo de cromo possui número atômico 24. Ou seja, quando está sob a forma neutra, possui 24 prótons e 24 elétrons. Sob a forma do cátion Cr3+, há a perda de três elétrons, portanto, ele possui agora 21 elétrons.
O item E está incorreto. No cátion Cr6+ o número de elétrons é menor do que o número de prótons, pois houve perda de elétrons para a formação do cátion. O número de prótons não é alterado na formação de íons.