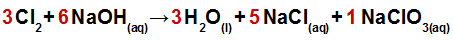Reações de auto-oxidorredução
Reações de auto-oxidorredução são aquelas em que há uma substância no reagente que apresenta um átomo sofrendo redução e outro sofrendo oxidação, ou seja, na reação, uma única substância atua como oxidante e redutor.
-
Oxidação: identificada a partir do aumento do NOX de um mesmo elemento químico, do reagente ao produto;
-
Redução: identificada a partir da diminuição do NOX de um mesmo elemento químico, do reagente ao produto.
Para facilitar a compreensão de uma reação de auto-oxidorredução, vamos partir de um exemplo prático. Acompanhe:
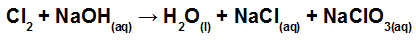
Identificando uma equação de auto-oxidorredução
-
Passo 1:
Para identificar uma reação de auto-oxidorredução, é fundamental que seja determinado o NOX de cada um dos átomos presentes em cada substância dos reagentes e dos produtos:
Cl2 = Cl apresenta NOX 0 por estar em uma substância simples;
NaOH = Na tem NOX +1 por ser da família IA; O apresenta NOX -2 por ser ametal da família VIA, e H tem NOX +1 por estar perto de um ametal mais eletronegativo);
H2O = O apresenta NOX -2 por ser ametal da família VIA, e o H tem NOX +1 por estar perto de um ametal mais eletronegativo;
NaCl = Na tem NOX +1 por ser da família IA, e o Cl apresenta NOX -1 para que a somatória dos NOX da molécula seja igual a 0;
NaClO3 = Na tem NOX +1 por ser da família IA; O apresenta NOX -2 por ser ametal da família VIA; e o NOX do Cl é +5, pois o Na vale +1 e os três oxigênios valem -6, o que resulta em uma soma de -5. Assim, para zerar, a molécula do Cl vale +5.
-
Passo 2: Analisar quais elementos apresentaram variação do NOX e qual é a característica dessa variação (se houve aumento ou diminuição do NOX).
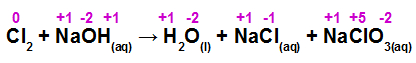
Analisando a equação, podemos observar que o único elemento químico que teve o NOX modificado do reagente para os produtos foi o Cloro (Cl). No reagente, o Cloro aparece com o NOX 0, mas, nos produtos, ele aparece com NOX -1 e +5.
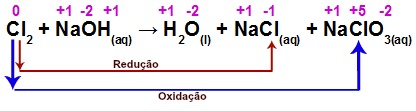
Quando o NOX do cloro varia de 0 a -1, do reagente para o produto, ele sofre o fenômeno da redução. Quando o NOX varia de 0 a +5, do reagente para o produto, ele sofre oxidação.
Como a espécie Cl2 está passando pelo fenômeno da redução e da oxidação simultaneamente, ou seja, ele é o agente oxidante e o agente redutor, podemos afirmar que se trata de uma reação de auto-oxidorredução.
Como balancear uma equação de auto-oxidorredução
Passo 1: determinar a variação do NOX para a redução e para a oxidação.
-
Para a oxidação: o NOX varia de 0 a +5, logo, a variação é de 5;
-
Para a redução: o NOX varia de 0 a -1, logo, a variação é de 1.
Passo 2: encontrar os coeficientes que serão utilizados no balanceamento.
Para isso, basta multiplicar a variação encontrada no fenômeno de redução ou oxidação pela quantidade de átomos na fórmula do reagente:
-
Para redução: 1.2 (número de átomos no Cl2) = 2;
-
Para oxidação: 5.2 (número de átomos no Cl2) = 10.
Como os dois números encontrados podem ser simplificados por 2, os coeficientes são:
-
Em reação à redução: 1;
-
Em reação à oxidação: 5.
Passo 3: utilizar as variações encontradas como coeficientes na equação para iniciar o balanceamento.
Devemos utilizar as variações encontradas no passo anterior como coeficientes nos produtos tomando o cuidado de utilizar a variação encontrada em um dos produtos como coeficiente do outro produto. Assim, a variação 1 será utilizada no produto NaClO3, e a variação 5 será utilizada no produto NaCl.
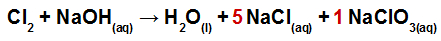
Passo 4: término do balanceamento da equação.
Para terminar o balanceamento da equação, basta utilizar o método da tentativa. Para isso, sempre é mais fácil verificar primeiro qual elemento químico já tem a sua quantidade definida no produto ou no reagente.
-
Detalhe 1: No produto dessa equação, a quantidade de sódio está fechada, sendo 6 mol de sódio (5 no NaCl e 1 no NaClO3). Por isso, é necessário adicionar o coeficiente 6 na fórmula do NaOH localizada no reagente;
-
Detalhe 2: No produto, a quantidade de cloro está fechada, sendo 6 mol de cloro (5 no NaCl e 1 no NaClO3). Por isso, é necessário adicionar o coeficiente 3 na fórmula do Cl2 localizada no reagente (3 porque, multiplicado pelo 2 da fórmula, resulta em 6, igualando a fórmula do reagente à do produto);
-
Detalhe 3: Como adicionamos o coeficiente 6 na fórmula NaOH, logo, a quantidade de hidrogênio está fechada no reagente. Por isso, devemos adicionar o coeficiente 3 na fórmula H2O, pois a multiplicação de 3 por 2 resulta em 6, igualando a fórmula à quantidade do reagente.