Reações inorgânicas
As reações inorgânicas são fenômenos químicos que envolvem a produção de substâncias inorgânicas com base em outras substâncias inorgânicas. Existem quatro tipos de reações inorgânicas: de adição, de decomposição, de simples troca, e de dupla troca.
As reações inorgânicas apresentam as mesmas condições das reações de modo geral, embora as reações de simples troca e dupla troca apresentem condições adicionais para sua ocorrência. As reações inorgânicas estão em nosso cotidiano, como na queima de um pedaço de carvão, na produção de amônia na indústria, na dissolução de um metal por um ácido, entre outras situações específicas.
Leia também: Afinal, o que são reações químicas?
Resumo sobre reações inorgânicas
- As reações inorgânicas são processos químicos de conversão de uma ou mais substâncias inorgânicas em outras substâncias também inorgânicas.
- São considerados quatro tipos de reações inorgânicas: adição (ou síntese), decomposição (ou análise), simples troca (ou deslocamento) e dupla troca (deslocamento).
- O tipo de reação inorgânica pode ser identificado de acordo com o equacionamento da reação química.
- As reações inorgânicas têm as mesmas condições gerais para ocorrência das reações químicas de modo geral, contudo, as reações de simples troca e dupla troca têm condições adicionais para ocorrência.
- Diversas são as reações inorgânicas presentes em nosso cotidiano, como a queima de carvão, a combustão do hidrogênio e a neutralização entre ácidos e bases.
O que são reações inorgânicas?
As reações inorgânicas são fenômenos químicos que envolvem a transformação de uma ou mais substâncias inorgânicas em uma ou mais substâncias inorgânicas. Consideramos como substâncias inorgânicas aquelas que não são orgânicas, como sais, óxidos, ácidos, bases, entre outros diversos compostos.
Tipos de reações inorgânicas
As reações inorgânicas podem acontecer por meio de quatro mecanismos específicos: adição (ou síntese), decomposição (ou análise), simples troca (ou deslocamento) e dupla troca (ou permutação). A seguir, conheça cada um deles:
- Reações inorgânicas de adição (ou síntese): ocorrem quando dois ou mais reagentes dão origem a um único produto.
A + B → AB
- Reações de decomposição (ou análise): ocorrem quando um único reagente se decompõe em dois ou mais produtos.
AB → A + B
- Reações de simples troca (ou deslocamento): ocorrem quando um elemento substitui um outro elemento similar em uma substância composta. Por exemplo, se o elemento tem caráter positivo, substituirá o elemento de caráter positivo da substância composta. Já se o elemento tem caráter negativo, substituirá o elemento de caráter negativo da substância composta.
A + BC → AC + B
- Reações de dupla troca (ou permutação): ocorrem quando os elementos de duas substâncias compostas permutam entre si, formando duas novas substâncias compostas. No caso, a espécie de caráter positivo da primeira substância composta se liga à espécie de caráter negativo da segunda substância composta, e a espécie de caráter positivo da segunda substância composta se liga à esspécie de caráter positivo da primeira substância composta.
AB + CD → AD + CB
Veja também: O que são reações orgânicas?
Como acontecem as reações inorgânicas?
De modo geral, toda reação química necessita dos seguintes princípios para ocorrência: afinidade química, energia de ativação e contato entre os reagentes. Contudo, alguns tipos de reações inorgânicas, mais especificamente a simples troca e a dupla troca, apresentam condições para ocorrência.
→ Condição específica de ocorrência de reações de simples troca
No caso de uma reação de simples troca (ou deslocamento), ela só ocorrerá se o elemento utilizado for mais reativo do que o elemento que será deslocado (ou substituído). Essa reatividade é apresentada por séries de tendências, obtidas experimentalmente. Para os elementos eletropositivos, temos a reatividade decrescente:
Metais alcalinos e alcalino-terrosos → Metais comuns → Hidrogênio → Metais nobres
Dessa forma, um metal alcalino é capaz de deslocar quase todos os elementos eletropositivos, mas um metal nobre dificilmente deslocará outro elemento eletropositivo:
- Mg + 2 HCl → MgCl2 + H2: reação ocorre, pois o magnésio, um metal alcalino-terroso, é mais reativo que o hidrogênio.
- Ag + Al(NO3)3 → não ocorre: a reação não se desenvolve, pois a prata, um metal nobre, é menos reativa que o alumínio, um metal comum.
Já para elementos eletronegativos, a reatividade decrescente é dada por:
F > O > Cl > Br > I > S
Dessa forma, o flúor é o mais reativo dos eletronegativos, podendo deslocar qualquer elemento da série; o oposto ocorre com o enxofre, incapaz de deslocar qualquer elemento da série.
- F2 + 2 NaBr → 2 NaF + Br2: a reação ocorre, dada maior reatividade do flúor frente ao bromo.
- I2 + NaCl → não ocorre: a reação não se desenvolve, pois o iodo é menos reativo que o cloro.
→ Condições específicas de ocorrência de reações de dupla troca
Para reações de dupla troca (ou permutação), há três condições adicionais para que elas ocorram:
- Um dos produtos deve ser menos solúvel que os reagentes, ou seja, deve precipitar:
NaCl + AgNO3 → AgCl + NaNO3
O cloreto de prata, AgCl, é um sal muito pouco solúvel em água, enquanto o NaCl e o AgNO3 são muito solúveis em água.
- Um dos produtos deve ser mais volátil que um dos reagentes:
FeS + 2 HCl → FeCl2 + H2S
No caso, o H2S é um produto volátil, diferentemente dos reagentes.
- Um dos produtos deve ter menor grau de ionização que um dos reagentes:
BaCO3 + H2SO4 → BaSO4 + H2CO3
O ácido sulfúrico é um ácido forte, apresentando-se ionizado em solução; diferentemente do ácido carbônico, fraco e com baixo grau de ionização.
Uma curiosidade é que essa reação contempla os outros dois critérios: o sulfato de bário é muito pouco solúvel em água, enquanto o carbonato de bário não; além disso, o ácido carbônico se decompõe em água e gás carbônico, sendo este último um produto volátil. Não à toa, a reação entre sulfato de bário e ácido carbônico não ocorre.
Reações inorgânicas no cotidiano

- Combustão completa do carvão: é configurada como uma reação de adição.
C (s) + O2 (g) → CO2 (g)
- Combustão do gás hidrogênio: altamente exotérmica e não poluente, pois só produz água, é uma reação de adição.
H2 (g) + ½ O2 (g) → H2O (g)
- Síntese da amônia: o processo Haber-Bosch, principal forma de produção de amônia na indústria, pode ser classificado como uma reação inorgânica de adição.
N2 (g) + 3 H2 (g) → 2 NH3 (g)
- Decomposição térmica do carbonato de cálcio: uma das reações mais conhecidas, ocorre em altas temperaturas (na faixa dos 800 °C) e produz óxido de cálcio.
CaCO3 (s) → CaO (s) + CO2 (g)
- Termólise do nitrato de amônio: a decomposição do nitrato de amônio é bastante exotérmica, por isso, quando aquecido, pode se tornar um explosivo perigoso. É uma reação de decomposição.
6 NH4NO3 → N2O + 10 H2O + NH4NO3 + 3 N2 + 2 NO2

- Decomposição do ácido carbônico: em meio aquoso, o ácido carbônico é instável, decompondo-se em gás carbôninco e água.
H2CO3 (aq) → H2O (l) + CO2 (g)
- Reação do sódio metálico com a água: um exemplo de reação de simples troca, o sódio metálico reage com a água, formando óxido de sódio e hidrogênio. Ocorre que a reação é tão exotérmica que é capaz de causar a ignição do gás hidrogênio, havendo, assim, risco de explosão.
2 Na (s) + H2O (l) → Na2O (aq) + H2 (g)
- Ataque de metais por ácidos: um exemplo clássico de reações de simples troca são as reações de metais por ácidos fortes, como ácido clorídrico. Essa reação explica por que alguns metais se dissolvem em meio ácido.
Zn (s) + 2 HCl (aq) → ZnCl2 (aq) + H2 (g)
- Reações de neutralização: as reações entre ácidos e bases são exemplos clássicos de reações de dupla troca. O sal é oriundo do ânion do ácido e do cátion da base, enquanto a água é formada pela ligação entre os íons H+ e OH−.
HCl (aq) + NaOH (aq) → NaCl (aq) + H2O (l)
Exercícios resolvidos sobre reações inorgânicas
Questão 1
(Enem) Um grupo de alunos realizou um experimento para observar algumas propriedades dos ácidos, adicionando um pedaço de mármore (CaCO3) a uma solução aquosa de ácido clorídrico (HCl), observando a liberação de um gás e o aumento da temperatura.
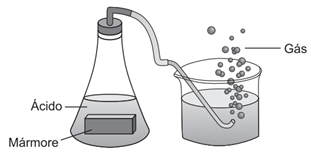
O gás obtido no experimento é o:
A) H2
B) O2
C) CO2
D) CO
E) Cl2
Resolução:
Alternativa C
A reação entre o carbonato de cálcio e o ácido clorídrico é a que se segue:
CaCO3 + 2 HCl → CaCl2 + H2CO3
Tal reação é de dupla troca e é possível de acontecer, visto que o ácido clorídrico, forte, é mais ionizável que o ácido carbônico, fraco. Além disso, o ácido carbônico, em água, decompõe-se em água e gás carbônico, um produto volátil, sendo essa mais uma condição para ocorrência da dupla troca. As bolhas, então, são do CO2 oriundo da decomposição do ácido carbônico.
Questão 2
(Uerj) Nas reações químicas de decomposição, uma substância composta se decompõe em duas ou mais substâncias.
Um exemplo de reação química de decomposição está representado em:
A) CaCO3 → CaO + CO2
B) MgO + H2O → Mg(OH)2
C) Zn + H2SO4 → ZnSO4 + H2
D) HNO3 + NaOH → NaNO3 + H2O
Resolução:
Alternativa A
As reações de decomposição são marcadas quando um único reagente produz dois ou mais produtos, algo só percebido na alternativa A.
Créditos da imagem
Fontes
CHATURVEDI, S.; DAVE, N. P. Review on Thermal Decomposition of Ammonium Nitrate. Journal of Energetic Materials, v. 31, p. 1-26, 2013.
FELTRE, R. Química. v. 1. 6ª ed. Moderna: São Paulo, 2004.


