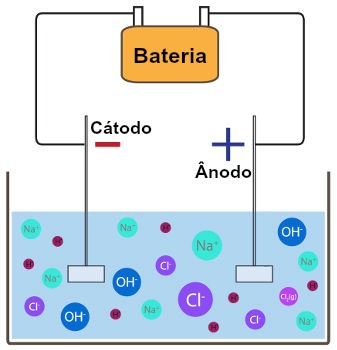
Descarga de cátions e ânions
A descarga seletiva de cátions e ânions é utilizada para determinar o tipo de substâncias (simples ou compostas) que serão formadas durante a ocorrência de uma eletrólise em meio aquoso (procedimento eletroquímico no qual uma corrente elétrica é descarregada sobre uma solução).
As substâncias simples ou compostas são formadas porque, durante a eletrólise, a descarga elétrica na solução faz com que cátions sofram o fenômeno de redução (recebimento de elétrons) e os ânions sofram oxidação (perda de elétrons por uma espécie química), como nas equações abaixo:
-
Equação de redução (cátodo): X+ + e → X
OBS.: O cátion X pode ser um metal qualquer ou o cátion hidrônio (H+ ou H3O+).
-
Equação de oxidação (ânodo): Y- → Y2 + e
OBS.: O ânion Y- pode ser um ametal, um grupo com um ametal qualquer ou o hidróxido (OH-).
Origem dos íons (cátions e ânions)
Quando um soluto iônico (ácidos, bases ou sais, por exemplo) é dissolvido em água, sofre dissociação (liberação de íons, no caso das bases e dos sais) ou ionização (produção de íons em meio aquoso, no caso dos ácidos).
-
Equação geral de dissociação de um sal: YX → Y+ + X-
-
Equação geral de dissociação de uma base: YOH → Y+ + OH-
-
Equação geral de ionização de um ácido: HX → H+ + X-
Além dos íons provenientes do soluto, o meio aquoso por si só também produz íons, já que a água apresenta a capacidade de sofrer autoionização (produz um cátion e um ânion).
-
Equação de autoionização da água: H2O → H+ + OH-
Assim, quando uma eletrólise em meio aquoso é realizada, há pelo menos dois cátions e dois ânions diferentes.
Descarga seletiva de cátions
Como vimos, quando uma eletrólise em meio aquoso está sendo realizada, temos a presença de dois cátions diferentes: um proveniente do soluto utilizado e o outro proveniente da água.
Sofre descarga sempre o íon ou grupo iônico menos eletronegativo. Para saber qual dos cátions sofrerá a descarga, basta conhecer a ordem de prioridade a seguir:
Qualquer metal > H+ > elementos das famílias IA, IIA ou IIIA
Se a eletrólise do cloreto de sódio estiver sendo realizada em meio aquoso, por exemplo, teremos o cátion sódio (Na+) proveniente do sal e o cátion hidrônio (H+) proveniente da água.
Como o cátion sódio pertence à família IA, logo, o cátion hidrônio sofrerá descarga no cátodo, formando gás hidrogênio, como na equação abaixo:
Equação catódica: H+ + 2e → H2(g)
Se o cátion que sofrer a descarga não for o hidrônio, teremos sempre a formação de um metal sólido (com exceção do mercúrio, que é líquido):
Equação catódica: Cu+2 + 2e → Cu(s)
Descarga seletiva de ânions
Como vimos, quando uma eletrólise em meio aquoso está sendo realizada, temos a presença de dois ânions diferentes: um proveniente do soluto utilizado e o outro proveniente da água.
Sofre descarga sempre o íon ou grupo iônico menos eletronegativo. Para saber qual dos ânions sofrerá a descarga, basta conhecer a ordem de prioridade a seguir:
Qualquer outro ânion > OH- > ânion oxigenado ou F-
Se a eletrólise do cloreto de sódio estiver sendo realizada em meio aquoso, teremos o ânion cloreto (Cl-) proveniente do sal e o ânion hidróxido (OH-) proveniente da água.
Como o ânion cloreto não é oxigenado (não apresenta oxigênio), sempre sofrerá descarga na eletrólise em meio aquoso, formando uma substância simples (geralmente formada por dois átomos), como na equação a seguir:
Equação anódica: 2 Cl- → Cl2(g) + 2e
Caso o ânion hidróxido sofra descarga, teremos a formação de gás oxigênio e de água:
Equação anódica: 2 OH- → ½ O2(g) + H2O + 2e