Termoquímica
A Termoquímica é o ramo da Química que estuda as trocas de calor em reações químicas e mudanças de estado, e por meio dela é possível compreender como a energia na forma de calor é absorvida ou liberada em processos químicos, entendendo, portanto, a eficácia e o comportamento das reações. Além disso, ela está intimamente ligada a outro termo: trabalho. Ou seja, explora, também, o trabalho que pode ser realizado por meio da energia produzida durante as reações químicas.
Nesse sentido, seu surgimento, no século XIX, foi marcado pela Revolução Industrial, quando a eficiência energética se tornou uma preocupação central devido ao crescente uso de máquinas a vapor e processos industriais em larga escala. Nessa época, entender como o calor era transferido e transformado em trabalho mecânico ou utilizado em reações químicas tornou-se vital para otimizar o uso de combustíveis e melhorar as atividades da indústria, o que permite o desenvolvimento de tecnologias mais sustentáveis e o melhor entendimento do impacto ambiental de atividades químicas.
Resumo sobre Termoquímica
- A Termoquímica é o ramo da Química que estuda as trocas de calor envolvidas em reações químicas e mudanças de estado, bem como a eficiência e o comportamento energético dos processos químicos.
- A variação de entalpia ΔH é a principal medida usada para quantificar o calor envolvido em uma reação.
- Reações exotérmicas liberam calor, resultando em ΔH negativo, enquanto reações endotérmicas absorvem calor, resultando em ΔH positivo.
- A lei de Hess afirma que a variação de entalpia de uma reação é independente do caminho ou das etapas intermediárias.
- A Termoquímica permite o cálculo de entalpias de reações complexas por meio de reações mais simples, utilizando a lei de Hess.
- A fórmula q = mcΔT é usada para calcular o calor trocado em um processo, em que m é a massa, c é o calor específico e ΔT é a variação de temperatura.
- Tem aplicações importantes na indústria química, produção de energia, engenharia, medicina, ciências ambientais e alimentos.
- É essencial para otimizar processos, melhorar a eficiência energética e desenvolver tecnologias sustentáveis.
- Exemplos práticos de cálculo incluem a determinação da entalpia de reações de combustão e decomposição, que ilustram o conceito de reações exotérmicas e endotérmicas.
O que é Termoquímica?
A Termoquímica é a área da Química que estuda as transformações de energia que envolvem as reações químicas, especialmente na forma de calor, investigando as trocas térmicas entre o sistema (onde ocorre a reação) e o ambiente ao seu redor. A palavra “Termoquímica” é formada pela junção de “termo-”, que se refere ao calor, e “química”.
O que a Termoquímica estuda?
A Termoquímica estuda como a energia é transferida entre o sistema, onde a reação química acontece, e o ambiente, ajudando a compreender se uma reação libera ou absorve calor. Para uma compreensão mais ampla das formas de fazer isso, uma série de estudos baseados no calor envolvido nas reações químicas foram desenvolvidos, contemplando diversas perspectivas, que nos livros didáticos de Química são organizados da seguinte forma:
- Calor de reação: estudo da quantidade de calor liberada ou absorvida durante uma reação química.
- Entalpia (ΔH): conceito e cálculo da variação de entalpia nas reações químicas, incluindo reações exotérmicas e endotérmicas.
- Lei de Hess: princípio que permite calcular a variação de entalpia de uma reação com base nas entalpias de reações intermediárias.
- Entalpias de formação e combustão: cálculo e interpretação das entalpias padrão de formação e de combustão.
- Calorimetria: técnicas de medição de calor em reações químicas usando calorímetros.
- Energia de ligação: estudo da energia envolvida na quebra e formação de ligações químicas.
- Espontaneidade das reações: Introdução ao conceito de energia livre de Gibbs e sua relação com a espontaneidade das reações.
- Diagramas de entalpia: representação gráfica das variações de entalpia ao longo de uma reação.
Fórmula da Termoquímica
A fórmula fundamental da Termoquímica calcula a variação de entalpia (ΔH) de uma reação química, que é dada por:
\(ΔH = H_{produtos} – H_{reagentes}\ ou\ ΔH = Hp - Hr\)
- Hp → entalpia total dos produtos ou entalpia final da reação.
- Hr → entalpia total dos reagentes ou entalpia inicial da reação.
Essa equação expressa a diferença entre a entalpia total dos produtos e a dos reagentes, sendo fundamental para entender como a energia térmica se comporta durante as reações químicas e como influenciam as mudanças de fase. Para saber detalhes sobre o cálculo da variação de entalpia, clique aqui.
Reações endotérmicas e exotérmicas da Termoquímica
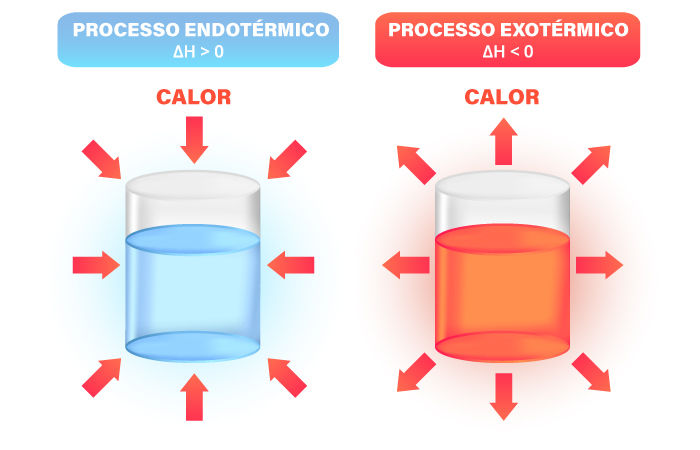
Reações endotérmicas e exotérmicas são processos estudados pela Termoquímica.
→ Reações endotérmicas da Termoquímica
Com base na fórmula da variação de entalpia, se o ΔH for positivo (ΔH > 0), a reação é endotérmica, logo absorve calor. A seguir, veja um exemplo de reação endotérmica.
- Decomposição térmica do carbonato de cálcio (CaCO3):
CaCO3 (s) + calor → CaO (s) + CO2 (g)
Como pode perceber, essa reação, usada na produção de cal viva (CaO), requer calor para ocorrer. Sendo assim, dispondo das entalpias de formação de cada espécie envolvida na reação, vejamos de forma prática a entalpia para esse processo:
CaCO3 (s): ΔHfº = - 1207 kJ/mol
CaO (s): ΔHfº = - 635,5 kJ/mol
CO2 (s): ΔHfº = - 393,5 kJ/mol
Calculando a variação de entalpia, temos:
ΔH = [(−635,5) + (−393,5)] − (−1207)
ΔH = −1029 − (−1207)
ΔH = −1029 + 1207
ΔH = + 178 kJ/mol
Esse valor positivo indica que a reação absorve 178 kJ/mol de calor, confirmando que é uma reação endotérmica.
→ Reações endotérmicas da Termoquímica
Com base na fórmula da variação de entalpia, se o ΔH for negativo (ΔH < 0), então a reação é exotérmica e, portanto, libera calor. A seguir, veja um exemplo de reação exotérmica.
- Combustão do metano (CH4):
As reações de combustão, em regra, são do tipo exotérmicas, uma vez que liberam calor, conforme o é exemplificado na equação abaixo:
CH4(g) + 2 O2 (g) → CO2 (g) + 2 H2O (g) + calor
Mas em termos quantitativos, qual a quantidade de calor liberada no exemplo do metano? Para responder tal questão, devemos levar em consideração o que chamamos de entalpia padrão de formação (ΔHfº), que, como o nome indica, é a entalpia envolvida na formação de cada substância isoladamente (não se preocupe, pois esses valores são tabelados). Sendo assim, para cada substância envolvida, temos:
CH4 (g): ΔHfº = -74,8 kJ/mol
O2 (g): ΔHfº = 0 kJ/mol (para substância simples é zero)
CO2 (g): ΔHfº = -393,5 kJ/mol
H2O (g): ΔHfº = -241,8 kJ/mol
Agora, basta aplicarmos esses dados na fórmula da variação de entalpia: ΔH = Hp - Hr
ΔH = (ΔHfº total dos produtos) – (ΔHfº total dos reagentes)
ΔH = [(−393,5) + 2 X (−241,8)] − [(−74,8) + 2 X (0)]
ΔH = [−393,5 + (−483,6)] − (−74,8)
ΔH = −877,1 + 74,8
ΔH = −802,3 kJ/mol
Esse valor negativo indica que a reação libera 802,3 kJ/mol de calor, confirmando que é uma reação exotérmica. Ou seja, a queima do metano libera calor para o ambiente.
Para saber mais detalhes sobre as reações endotérmicas e exotérmicas, clique aqui.
Termoquímica e calor
Na Termoquímica, especificamente em experimentos calorimétricos, existe uma equação que é útil para experimentos práticos nos quais se mede a mudança de temperatura a fim de determinar a quantidade de calor envolvida no processo, dada pela seguinte relação:
q = m ⋅ c ⋅ ΔT
- q → calor absorvido ou liberado.
- m → massa da substância.
- c → calor específico da substância.
- ΔT → variação de temperatura (Tfinal – Tinicial).
Exemplo:
Imagine que você tem 200 gramas de água que sofreu um aumento de temperatura de 10°C. Sabendo que o calor específico da água é 4,18 J/g °C, calcule o calor (q) liberado.
Resolução:
m = 200 g c = 4,18 J/g°C ΔT = 10°C
Substituindo os valores:
q = m ⋅ c ⋅ ΔT
200 ⋅ 4,18 ⋅ 10
q = 200 ⋅ 41,8
q = 8.360 J
Logo, ao aumentar a temperatura em 10 ºC, 8.360 J são liberados em forma de calor.
Termoquímica e a entalpia
A entalpia é uma medida da energia total de um sistema termodinâmico, isto é, a energia interna e a energia associada à pressão e volume do sistema. Em termos práticos, ela é usada para descrever a quantidade de energia envolvida em processos químicos e físicos, como reações e mudanças de estado, e pode ser calculada pela seguinte expressão:
H = U + PV
- H → entalpia.
- U → energia interna.
- P → pressão.
- V → volume.
Para saber mais detalhes sobre a entalpia, clique aqui.
Termoquímica e a lei de Hess
A lei de Hess é um princípio da Termoquímica que afirma que a variação total de entalpia de uma reação química é a mesma, independentemente de o processo ocorrer em uma única etapa ou em várias etapas. Em outras palavras, a variação de entalpia de uma reação depende apenas dos estados iniciais e finais dos reagentes e produtos, e não do caminho ou das etapas intermediárias da reação. Isso permite calcular a entalpia de reações complexas somando as entalpias de reações mais simples que, juntas, levam ao mesmo resultado final.
Vamos considerar a aplicação da lei de Hess e determinar a entalpia da seguinte reação:
C (s) + O2 (g) → CO2 (g)
Suponha que não conhecemos diretamente a entalpia dessa reação, mas conhecemos as entalpias das seguintes reações:
- Queima de carbono para formar monóxido de carbono (CO):
C (s) + ½ O2 (g) → CO (g) ΔH1 = − 110,5 kJ
- Oxidação do monóxido de carbono para formar dióxido de carbono (CO2):
CO (g) + ½ O2 (g) → CO2 (g) ΔH2 = − 283,0 kJ
Para encontrar a entalpia da reação de formação do CO2, somamos as duas reações intermediárias:

Logo, podemos constatar como a lei de Hess permite calcular a entalpia de uma reação complexa por meio de reações mais simples e conhecidas.
Para saber mais detalhes sobre a lei de Hess, clique aqui.
Aplicações da Termoquímica
A Termoquímica possui várias aplicações práticas em setores variados, como:
- Indústria química: na otimização de processos industriais, como a produção de amônia pelo processo Haber-Bosch, em que o controle de temperatura e entalpia é crucial para maximizar a eficiência.
- Energia: no desenvolvimento e aprimoramento de combustíveis, tanto fósseis quanto alternativos, através da análise do calor liberado em reações de combustão.
- Engenharia e tecnologia: no projeto de motores e sistemas de energia, como turbinas a gás e motores de combustão interna, em que a eficiência depende diretamente da gestão do calor gerado.
- Ciências ambientais: na avaliação do impacto ambiental de processos químicos, incluindo o estudo de reações que contribuem para o efeito estufa, como a combustão de combustíveis fósseis.
- Medicina e farmacologia: no desenvolvimento de medicamentos e tratamentos que envolvem reações químicas controladas dentro do corpo humano, onde a liberação ou absorção de calor pode influenciar a eficácia e segurança do tratamento.
- Alimentos e bebidas: no controle de processos como pasteurização, fermentação e cozimento, que dependem de reações químicas e trocas de calor para garantir a qualidade e segurança dos produtos.
Importância da Termoquímica
A importância da Termoquímica é percebida em suas aplicações, uma vez que ela nos permite entender e controlar a energia envolvida em reações químicas, nos ajuda a otimizar processos, melhorar a eficiência energética e minimizar impactos ambientais, garantindo que as reações ocorram de maneira segura e eficiente. Compreendê-la, portanto, é fundamental para inovar em tecnologias sustentáveis, criar novos materiais e melhorar a qualidade de vida em áreas como saúde e alimentação.
Veja também: Eletroquímica — o ramo da Química que estuda as interações entre reações químicas e corrente elétrica
Exercícios resolvidos sobre Termoquímica
Questão 1
(Univiçosa) Ao se misturar 100 mL de HCl 1/mol/L com 100 mL de NaOH de mesma concentração, obtém-se uma solução de NaCl (sal de cozinha) e observa-se claramente um aumento de temperatura.
Diante do exposto, pode-se afirmar que se trata de uma reação
A) endotérmica
B) exotérmica
C) isotérmica
D) isotônica
Resolução:
Alternativa B.
O aumento de temperatura indica perda de calor do sistema para o meio externo, ou seja, é uma reação exotérmica.
Questão 2
(UFGD) A queima de combustíveis fósseis está associada à liberação de gases SOx que, por sua vez, estão relacionados à formação de chuva ácida em determinadas regiões do planeta. Segundo a lei de Hess, a variação de entalpia de uma transformação química depende somente dos estados iniciais e finais de determinada reação. Calcule, com base nas equações químicas a seguir, a variação de entalpia da reação de produção de gás SO3(g) liberado na atmosfera pela queima do enxofre contido em um combustível fóssil.
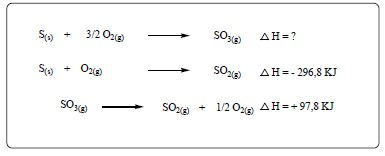
A) – 394,6 KJ
B) + 394,6 KJ
C) - 199 KJ
D) + 199 KJ
E) -195,6 KJ
Resolução:
Alternativa A.
Primeiro, devemos identificar qual dentre as equações apresentadas representa a reação de combustão (queima) do enxofre produzindo SO3. Nesse caso, é a primeira equação dada. Logo, ela representa a nossa equação global, que fica abaixo da linha. Agora, devemos verificar nas equações se cada componente (produtos e reagentes) está posicionado corretamente nos respectivos lados da equação. Partindo disso, podemos verificar que o SO3 está do lado dos reagentes, então devemos inverter a equação para adequá-la à reação global em que haverá a formação de SO3:
|
SO2 (g) + ½ O2 (g) → SO3 (g) ΔH = - 97,8 kJ |
Perceba que se invertermos o sentido da reação, o sinal da variação de entalpia também muda.
Sendo assim, agora basta cancelar os componentes iguais dos lados opostos da reação e em seguida somar as variações de entalpia, conforme é mostrado a seguir:
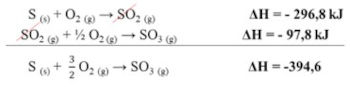
Fontes
ATKINS, P.; JONES, L. A Termoquímica. In: Pricípios de Química: Questionando a vida moderna e o meio ambiente. 5. ed. [s.l.] Bookman, 2012. p. 273–285.
FELTRE, R. Termoquímica. In: Química: Físico-Química. 6. ed. São Paulo: Moderna, 2004. v. 2p. 95–121.
L. BROWN, T. et al. Termoquímica. In: Química: A Ciência Central. 13. ed. São Paulo: Pearson Education do Brasil., 2016. p. 170–197.
REIS, M. Reações exotérmicas e endotérmicas. In: Química. 1. ed. São Paulo: Editora Ática, 2013. v. 2p. 136–145.


