Reações com hidretos
As reações com hidretos ocorrem quando esse grupo de substâncias inorgânicas entra em contato com a água, fato esse que promove a liberação de uma grande quantidade de energia e a produção de importantes substâncias (bases inorgânicas e gás hidrogênio).
No entanto, nem todo hidreto reage com a água. Existem três formas de hidretos (iônicos, metálicos e moleculares), mas apenas os iônicos possuem a capacidade de reagir com a água.
→ Hidretos iônicos
Hidretos iônicos são todas as substâncias que apresentam o elemento hidrogênio ligado a metais alcalinos, metais alcalinoterrosos ou metais da família do boro.
→ Princípios da reação com hidretos
Um hidreto iônico é formado por um cátion (metal) e um ânion (hidrogênio), e a água é formada pelo cátion hidrônio (H+) e o ânion hidróxido (OH-). Assim, podemos enquadrar uma reação com hidretos nos moldes de uma reação de dupla troca (cátion de uma substância com o ânion da outra e vice-versa).
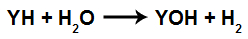
Equação geral de uma reação com hidreto
De uma forma geral, podemos resumir os princípios das reações com hidretos e água da seguinte forma:
-
o cátion do hidreto(Y+) une-se ao hidróxido (OH-) da água, formando uma base inorgânica (YOH):
.jpg)
Íons envolvidos na formação da base
-
o ânion do hidreto (H-) une-se ao cátion (H+) da água, formando o gás hidrogênio (H2).
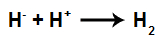
Íons envolvidos na formação do gás hidrogênio
→ Exemplos de reações com hidretos
1º) Reação com hidreto de sódio (NaH)
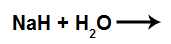
Equação com água e hidreto de sódio
Quando o cátion Na+1 (+1 por ser da família IA) interage com o hidróxido (OH-1), temos a formação do hidróxido de sódio (NaOH):
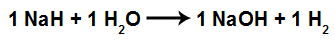
Equação balanceada da formação do hidróxido de sódio
2º) Reação com hidreto de magnésio (MgH2)
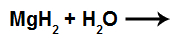
Equação com água e hidreto de magnésio
Quando o cátion Mg+2 (+2 por ser da família IIA) interage com o hidróxido (OH-1), temos a formação do hidróxido de magnésio [Mg(OH)2].
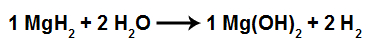
Equação da formação do hidróxido de magnésio
Para balancear a equação após a representação dos produtos, é necessário utilizar os coeficientes 1, 2, 1 e 2.
3º): Reação com hidreto de alumínio (AlH3)
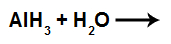
Equação com água e hidreto de alumínio
Quando o cátion Al+3 (+3 por ser da família IIIA) interage com o hidróxido (OH-1), temos a formação do hidróxido de alumínio [Al(OH)3].

Equação da formação do hidróxido de alumínio
Para balancear a equação após a representação dos produtos, é necessário utilizar os coeficientes 1, 3, 1 e 3.

