Solução-tampão
A solução-tampão é uma mistura homogênea formada pela junção de duas outras soluções aquosas (misturas homogêneas nas quais o solvente é a água): uma de um ácido (HX) ou base (YOH) fraca e outra de um sal (ZX ou YD).
As bases fracas são aquelas que não apresentam elementos das famílias IA e IIA, exceto o elemento magnésio (pertencente à família IIA). Já os ácidos fracos são todos aqueles cuja subtração do número de oxigênios pelo número de hidrogênios resulta em 1 ou quando não são HCl, HBr, HI ou HF.
Assim, de acordo com a definição acima, temos a possibilidade de formar dois tipos diferentes de solução-tampão:
→ Solução-tampão ácida:
É o tampão formado por um ácido fraco (HX) e um sal solúvel (ZX). É importante observar que o sal deve apresentar o mesmo ânion do ácido utilizado. Como apresenta ácido, essa solução sempre apresenta um pH menor que 7.
→ Solução-tampão básica:
É o tampão formado por soluções com uma base fraca (YOH) e um sal solúvel (YD). É importante observar que o sal deve apresentar o mesmo ânion da base utilizada. Como apresenta base, essa solução sempre apresenta um pH maior que 7.
Característica fundamental de uma solução-tampão
Além de saber reconhecer quando temos uma solução-tampão, devemos conhecer a sua característica fundamental, que é a chamada capacidade tamponante.
Define-se capacidade tamponante como a capacidade da solução-tampão de não sofrer mudanças significativas no seu pH ao receber soluções formadas por bases ou ácidos fortes.
É importante lembrar que existe um limite para as quantidades de ácido ou de base adicionadas a uma solução-tampão antes que um dos componentes seja totalmente consumido. Esse limite é conhecido como a capacidade tamponante de uma solução-tampão e é definido como a quantidade de matéria de um ácido ou base forte necessária para que um litro da solução-tampão sofra uma variação de uma unidade no pH.
Efeito da adição de ácido forte a uma solução-tampão
Vamos supor que temos uma solução-tampão formada pelo ácido HX e o sal ZX. O ácido em água ioniza-se pouco (por ser fraco, produz poucos íons) e o sal dissociar-se muito (libera muitos íons) por ser solúvel.
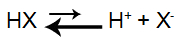
Equação de ionização de um ácido qualquer

Equação de dissociação de um sal qualquer
Como o ácido ioniza-se pouco, seu equilíbrio é deslocado para a esquerda (formação do ácido), enquanto o equilíbrio da dissociação do sal é deslocado para a direita por ser solúvel (liberação dos íons).
Se adicionarmos um pouco de ácido forte, como o HCl, teremos um aumento da quantidade de H+ no tampão, já que esse ácido ioniza-se muito (equilíbrio deslocado para a direita):
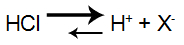
Equação de ionização do ácido HCl
O H+ proveniente do ácido forte interage com o X- proveniente do sal, formando novas moléculas do ácido:
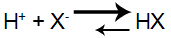
Equação de formação do ácido
O pH da solução não sofre alteração porque os H+ que foram adicionados são neutralizados pelos ânions CN- provenientes do sal.
Efeito da adição de uma base a uma solução-tampão
Se adicionarmos uma base forte, como o NaOH, teremos um aumento da quantidade de OH- no tampão, já que essa base dissocia-se muito (equilíbrio deslocado para a direita):

Equação de dissociação do NaOH
O OH- proveniente da base forte interage com o H+ proveniente do ácido, formando moléculas de água:
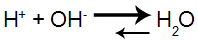
Equação de formação da água
O pH da solução não sofre alteração porque as moléculas de água formadas aumentam a ionização do ácido HX, normalizando a quantidade de H+.
Exemplo de solução-tampão
Um exemplo de solução-tampão é a mistura formada por uma solução de ácido hipobromoso (HBrO) e uma solução de hipobromito de sódio (NaBrO). Trata-se de uma solução-tampão porque o ácido hipobromoso é fraco e o sal hipobromito de sódio apresenta um íon em comum com o ácido, que é o ânion cianeto (BrO-).
Veja as equações de equilíbrio para o sal e para o ácido:
-
Para o ácido
O ácido hipobromoso é um ácido fraco (produz poucos íons). Sua equação de equilíbrio apresenta-se deslocada para a esquerda (sentido de formação do ácido), ou seja, a reação reversível ocorre mais do que a de formação dos íons.
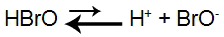
Equação que representa o equilíbrio de ionização do ácido
-
Para o sal
Por ser solúvel em água, o hipobromito de sódio sofre dissociação, liberando muitos íons. Dessa forma, sua equação de equilíbrio está deslocada para a direita (sentido de liberação dos íons), ou seja, a reação direta ocorre mais que a inversa (formação do sal).
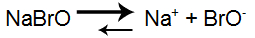
Equação que representa o equilíbrio de dissociação do sal
a) Se adicionarmos a base KOH
O KOH é uma base forte, logo, adicionará íons OH- no meio, que interagirão com o H+ do ácido, formando água. O aumento da quantidade de água favorece o aumento da ionização do ácido HBrO, mantendo a quantidade de H+ e o pH constantes.
b) Se adicionarmos o ácido HI
O HI é um ácido forte, logo, adicionará íons H+ no meio, que interagirão com o BrO- do sal, formando o ácido HBrO.