Tipos de ligações sigma
Os tipos de ligações sigma (representadas pela letra grega σ) presentes entre os átomos de uma molécula estão relacionados com o tipo de orbital incompleto de cada elemento químico que está envolvido na ligação.
Temos a ocorrência de uma ligação sigma sempre que entre dois átomos ocorre uma ligação covalente simples, dupla (na qual uma ligação é sigma e a outra ligação é pi) ou tripla (na qual uma é sigma e as outras duas são pi).
Obs.: As ligações pi (representadas pela letra grega π) são sempre do tipo p-p, diferentemente da ligação sigma, que apresenta vários tipos.
Para reconhecer os tipos de ligações sigma em um composto químico, é fundamental que conheçamos o orbital incompleto de cada um dos elementos que podem participar da formação dessas ligações covalentes, como podemos observar a seguir:
• Orbital s: sempre que o elemento hidrogênio estiver envolvido;
• Orbital p: sempre que os elementos flúor (sigla F), cloro (sigla Cl), bromo (sigla Br), iodo (sigla I), oxigênio (sigla O), enxofre (sigla S), nitrogênio (sigla N) ou fósforo (sigla P) estiverem envolvidos;
• Orbital sp: sempre que os elementos berílio (sigla Be) e carbono (sigla C) estiverem envolvidos, desde que o carbono esteja realizando duas ligações duplas ou uma ligação simples e outra tripla;
Veja também: Hibridização do berílio
![]()
Carbono em situações nas quais apresenta orbital sp incompleto
• Orbital sp2: sempre que os elementos boro (sigla B) e carbono estiverem envolvidos, desde que o carbono esteja realizando duas ligações simples e uma ligação dupla;
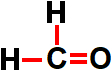
Carbono em situação na qual apresenta orbital sp2 incompleto
• Orbital sp3: sempre que os elementos carbono e silício (sigla Si) estiverem envolvidos, desde que eles estejam realizando apenas ligações simples;
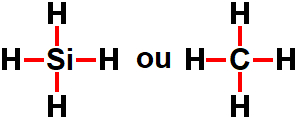
Silício e carbono em situação na qual apresentam orbital sp3 incompleto
Veja também: Hibridização sp3 do carbono
Tipos de ligações sigma
Conforme vimos, existem alguns tipos específicos de orbitais atômicos nos átomos dos elementos químicos. São esses orbitais atômicos que se interpenetram durante a ocorrência de uma ligação sigma. Logo, o tipo de ligação sigma entre dois átomos depende do tipo de orbital que cada um apresenta. Os tipos de ligação sigma são:
• Sigma s-p
• Sigma p-p
• Sigma s-s
• Sigma p-sp
• Sigma p-sp2
• Sigma p-sp3
• Sigma sp-sp
• Sigma sp2-sp2
• Sigma sp3-sp3
• Sigma sp2-sp3
• Sigma sp-sp3
• Sigma sp-sp2
Exemplos
Exemplo 1: Água (H2O)
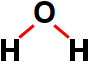
Ligações presentes na fórmula estrutural da água
A molécula de água apresenta duas ligações sigma envolvendo os elementos hidrogênio (orbital s) e oxigênio (orbital p), logo, possui duas ligações sigma do tipo s-p (σs-p).
Exemplo 2: Trifluoreto de boro (BF3)
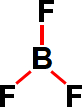
Ligações presentes na fórmula estrutural do trifluoreto de boro
A molécula de trifluoreto de boro apresenta três ligações sigma envolvendo os elementos flúor (orbital p) e boro (orbital sp2), logo, possui três ligações sigma do tipo p-sp2 (σp-sp2).
Exemplo 3: Etano (C2H6)
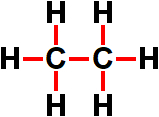
Ligações presentes na fórmula estrutural do etano
A molécula do etano apresenta seis ligações sigma envolvendo os elementos hidrogênio (orbital s) e carbono (orbital sp3, pois realiza apenas ligações simples), logo, possui seis ligações sigma do tipo s-sp3 (σs-sp3).

