Tópicos fundamentais sobre Cinética Química

A Físico-química é a parte da Química que historicamente sempre foi muito cobrada nos vestibulares. Com o advento do Enem, é provável que ela passe a ser cobrada com frequência. Por isso, neste texto, temos como missão descrever quais são os tópicos fundamentais de Cinética Química para qualquer processo seletivo.
A Cinética Química estuda a velocidade das reações, bem como os fatores que influenciam essa velocidade, além de buscar formas de realizar o controle da velocidade de uma reação.
Os tópicos fundamentais que todo aluno deve conhecer sobre Cinética Química são:
1- Condições fundamentais para a ocorrência das reações
a) Contato entre os reagentes
Para que uma reação química aconteça, é fundamental que os reagentes entrem em contato. Vale ressaltar que, durante o contato entre os reagentes, as moléculas realizam a chamada colisão favorável.
Denomina-se de colisão favorável o choque entre moléculas no qual todos ou a maioria dos átomos entra em contato entre si, como no modelo representado abaixo:
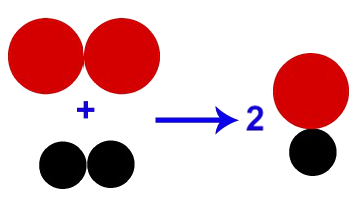
Representação de uma colisão favorável
b) Energia de ativação e complexo ativado
Energia de ativação é a energia mínima necessária que deve ser fornecida aos reagentes para que seja formado o complexo ativado (composto intermediário formado por todos os átomos envolvidos nos reagentes):
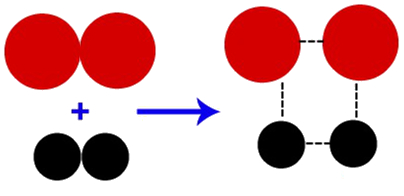
Representação da formação de um complexo ativado
O produto somente é formado quando algumas ligações presentes no complexo ativado são rompidas.
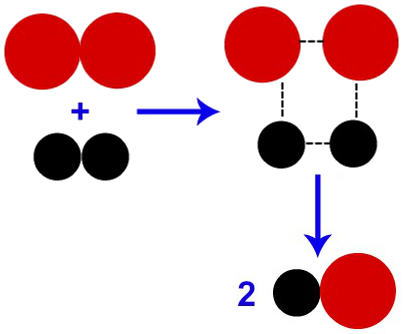
Representação da formação do produto após a formação do complexo ativado
A energia de ativação e o complexo ativado podem ser representados em um gráfico. O complexo ativado está sempre posicionado no ponto mais alto da curva (seta vermelha), enquanto a energia de ativação começa nos reagentes e termina no complexo ativado (seta azul).
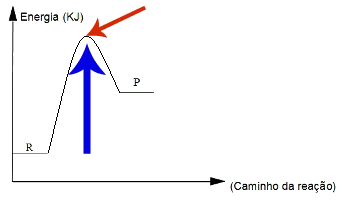
Gráfico sobre a energia de ativação e o complexo ativado de uma reação química
2- Fatores que influenciam a velocidade de uma reação
a) Natureza dos reagentes
A quantidade de átomos presentes em cada um dos reagentes influencia a velocidade de uma reação, já que, quanto maior o número de átomos na molécula, mais tempo será gasto para que eles sejam separados (quebra das ligações) para a formação do complexo ativado.
Considere os processos a seguir:
Processo 1: CH4 + 2O2 → CO2 + 2H2O
Processo 2: 2H2 + O2 → 2H2O
Podemos sugerir que o processo 2 ocorre com maior velocidade, pois seus reagentes são formados por moléculas com poucos átomos. No processo 1, um dos reagentes apresenta cinco átomos.
Denomina-se de superfície de contato a área de contato de um reagente com outro reagente ou de um reagente com um agente (temperatura, pressão etc). Um exemplo de influência da superfície de contato é o cozimento de batatas.
Batatas inteiras demoram mais para cozinhar porque o calor da chama tem mais dificuldade de alcançar as partes mais internas. Se cortarmos as batatas e colocarmos para cozinhar, o calor alcançará uma maior área de contato, sendo distribuído de forma mais rápida.
c) Luz
Existem reações que só ocorrem na presença de luz, como é o caso da eletrólise. Assim, quanto maior a quantidade de energia fornecida para a reação, mais rapidamente ele se processa. Um exemplo é a decomposição do brometo de prata (AgBr), formando prata metálica (Ag) e bromo líquido (Br2).
d) Pressão
A pressão está relacionada com a diminuição do volume de um espaço, assim, ao elevar a pressão em um sistema composto por gases, favorecemos que as moléculas entrem em contato e, consequentemente, realizem um maior número de colisões, aumentando a velocidade da reação.
e) Temperatura
O aumento da temperatura favorece o aumento da energia cinética das partículas. Com isso, elas passam a colidir mais entre si, tornando a reação mais rápida. Já a diminuição da temperatura favorece a diminuição da energia cinética das colisões e, consequentemente, da velocidade da reação.
A concentração de reagentes refere-se à quantidade de partículas que existem nos reagentes. Assim, quanto maior a quantidade de moléculas existentes, maior será a possibilidade de colisões efetivas entre elas, aumentando, assim, a velocidade da reação.
g) Catalisador
O catalisador favorece a formação do complexo ativado em um menor tempo e com uma menor quantidade de energia de ativação. Ao final da reação, ele pode ser removido integralmente do meio reacional, pois não participa de nenhum dos produtos.
h) Eletricidade
Existem reações que só ocorrem na presença de eletricidade, como é o caso da eletrólise. Assim, quanto maior a quantidade de energia fornecida para a reação, mais rapidamente ela se processa.
3- A ordem de uma reação não elementar
Tanto para a reação elementar quanto para a reação não elementar podemos realizar o cálculo da velocidade da reação pela chamada expressão da velocidade:
v = K. [A]a.[B]b
Na expressão da velocidade, utilizamos apenas as concentrações molares dos reagentes da reação, elevadas aos seus respectivos coeficientes estequiométricos.
Em uma reação não elementar (aquela que, para ocorrer, depende de algumas etapas), é necessário encontrar os valores das ordens (coeficientes) utilizadas na expressão da velocidade. Esses coeficientes podem ser encontrados pela análise de tabelas, geralmente fornecidas pelos exercícios, como no exemplo abaixo:
Exemplo: Com a reação genérica e a tabela que indica as velocidades e as concentrações em mol/L dos reagentes, determine a expressão da velocidade dessa reação.
X + Y → Z + W
|
Velocidade |
[X] em mol/L |
[Y] em mol/L |
|
10 |
5 |
10 |
|
40 |
10 |
10 |
|
40 |
10 |
20 |
- Ordem para o X: Utilizaremos as expressões 1 e 2 porque a concentração de X muda, e a de Y, não.
Concentração: da primeira para a segunda, ela dobra (de 5 para 10);
Velocidade: da primeira para a segunda, ela quadruplica (de 10 para 40).
Como a velocidade aumentou 4 vezes e a concentração aumentou 2 vezes, logo, a relação deles é de 4 para 2 e, por isso, a ordem é 2.
-
Ordem para o Y: Utilizaremos as expressões 2 e 3 porque a concentração de Y muda, e a de X, não.
Concentração: da primeira para a segunda, ela dobra (de 10 para 20);
Velocidade: da primeira para a segunda, não se modifica (mantém 40).
Como a concentração aumenta e a velocidade não se modifica, dizemos que esse participante não influencia a velocidade, logo, sua ordem é zero. Com esses dados, a expressão da velocidade para essa reação é:
v = K. [X]2.[Y]0
4- Exemplo de questão aplicada em processos seletivos
O exemplo a seguir mostra um exercício de Cinética Química que já foi aplicado em uma das provas do Enem:
(Enem/2010) Alguns fatores podem alterar a rapidez das reações químicas. A seguir destacam-se três exemplos no contexto da preparação e da conservação de alimentos:
1. A maioria dos produtos alimentícios se conserva por muito mais tempo quando submetidos à refrigeração. Esse procedimento diminui a rapidez das reações que contribuem para a degradação de certos alimentos.
2. Um procedimento muito comum utilizado em práticas de culinária é o corte dos alimentos para acelerar o seu cozimento, caso não se tenha uma panela de pressão.
3. Na preparação de iogurtes, adicionam-se ao leite bactérias produtoras de enzimas que aceleram as reações envolvendo açúcares e proteínas lácteas.
Com base no texto, quais são os fatores que influenciam a rapidez das transformações químicas relacionadas aos exemplos 1, 2 e 3, respectivamente?
a) Temperatura, superfície de contato e concentração.
b) Concentração, superfície de contato e catalisadores.
c) Temperatura, superfície de contato e catalisadores.
d) Superfície de contato, temperatura e concentração.
e) Temperatura, concentração e catalisadores.
Resposta do exercício: Letra c). A resposta é a letra c) porque:
-
Item I: aborda o resfriamento, o qual está relacionado com a mudança de temperatura;
-
Item II: aborda o corte dos alimentos para cozimento, o que aumenta a superfície de contato;
-
Item III: aborda o uso de enzimas, que são catalisadores biológicos.
Ferramentas Brasil Escola

Artigos Relacionados

Últimas notícias
Outras matérias


















