Influência da pressão na velocidade das reações

A taxa de desenvolvimento ou velocidade das reações químicas depende de uma série de fatores, tais como a superfície de contato, o uso ou não de catalisadores, a concentração dos participantes da reação e a variação da temperatura. Para saber mais sobre esses fatores que influenciam na velocidade da reação, aumentando-a ou diminuindo-a, leia os textos a seguir:
- Influência da superfície de contato na velocidade das reações;
- Influência dos catalisadores na velocidade das reações;
- Influência da Concentração na Velocidade das Reações;
- Temperatura e velocidade das reações.
No entanto, outro fator que interfere na velocidade das reações e que nem sempre é mencionado é a variação da pressão exercida sobre o sistema.
Mantendo a temperatura do sistema constante, um aumento da pressão causa um aumento da velocidade das reações químicas e vice-versa.
Isso ocorre porque, conforme dito no texto Teoria das Colisões, uma das condições fundamentais para que uma reação ocorra é que as moléculas ou partículas dos reagentes que entraram em contato colidam de modo efetivo, com a orientação correta e com a energia mínima necessária (energia de ativação), resultando na quebra das ligações dos reagentes e formação de novas substâncias (produtos).
Assim, quando aumentamos a pressão sobre o sistema, o volume diminui e as moléculas ou partículas dos reagentes ficam mais próximas umas das outras, o que aumenta a probabilidade de ocorrência de colisões entre essas partículas e, consequentemente, a velocidade da reação aumenta.
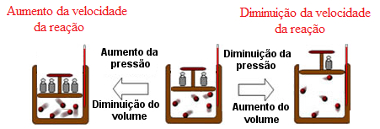
O aumento da pressão sobre o sistema diminui o volume e acelera a reação
Essa influência da pressão na velocidade das reações ocorre em todos os casos, sejam sólidos, líquidos ou gasosos. Porém, no caso dos sólidos e líquidos, essa variação é desprezível e, portanto, o efeito da pressão só é considerável quando todos os participantes da reação encontram-se no estado gasoso.
Inclusive, o estado físico também é outro fator que altera a taxa de desenvolvimento de uma reação. A rapidez da reação ocorre na seguinte ordem crescente:
sólido < líquido < gasoso
As substâncias no estado gasoso reagem com maior velocidade porque elas possuem maior energia, o que lhes confere maior liberdade de movimento e aumenta a probabilidade de ocorrerem colisões favoráveis.
Ferramentas Brasil Escola
Artigos Relacionados

Últimas notícias
Outras matérias


















