Isomeria em compostos cíclicos
A isomeria é um fenômeno que ocorre quando dois ou mais compostos orgânicos possuem a mesma fórmula molecular, mas se diferenciam na estrutura. Os dois principais tipos de isomeria são a constitucional (mais conhecida como isomeria plana, no entanto, esse termo não é o mais correto e nem indicado pela IUPAC, pois não existe molécula plana) e a estereoisomeria (isomeria espacial).
Essas duas classes de isomerias subdividem-se em outros tipos. Todavia, quando falamos em isomeria em compostos cíclicos, nem todos esses tipos ocorrerão. Vejamos quais são, então, os casos de isomeria que ocorrem nos compostos de cadeia fechada não aromáticos.
Considerando primeiramente a isomeria constitucional, ela é subdividida em cinco grupos: isomeria de função, isomeria de cadeia, isomeria de posição, isomeria de compensação ou metameria e isomeria dinâmica ou tautomeria. Entre esses grupos, somente a isomeria de cadeia e a isomeria de posição envolvem os compostos cíclicos:
* Isomeria de cadeia: Esse tipo de isomeria pode envolver compostos cíclicos de três formas:
1- Quando um composto apresenta cadeia fechada e outro apresenta cadeia aberta, como no exemplo a seguir em que os compostos possuem a mesma fórmula molecular (C5H10), mas se diferenciam pelo fato de que um apresenta cadeia aberta e o outro possui cadeia fechada:
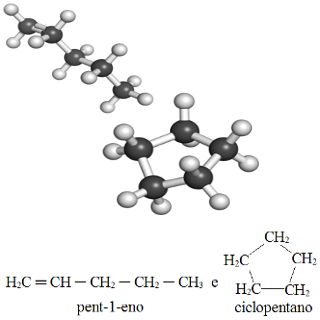
Exemplo de isomeria de cadeia entre o pent-1-eno e o ciclopentano
2- Quando um isômero possui insaturação (ligação dupla) e o outro possui cadeia saturada (possui somente ligações simples entre carbonos). O exemplo acima é também um caso que se enquadra nessa diferença.
3- Quando um isômero possui cadeia normal e o outro possui cadeia ramificada.
Exemplo:
Isômeros de cadeia (normal e ramificada)
* Isomeria de posição: Os isômeros podem diferenciar-se pela posição do substituinte. Esse tipo de isomeria ocorre em compostos cíclicos com, no mínimo, cinco átomos de carbono.
Exemplo:
Isomeria de posição: 1,1-dimetilciclopropano e 1,2-dimetilciclopropano
Em relação à estereoisomeria (isomeria espacial), ela subdivide-se em dois tipos: isomeria geométrica (cis-trans) e isomeria óptica. Esses dois tipos ocorrem com compostos cíclicos. Veja como:
* Isomeria geométrica cis-trans: Para que essa isomeria ocorra com compostos cíclicos, é necessário que haja grupos ligantes diferentes em pelo menos dois carbonos do ciclo, conforme mostrado a seguir:
Esquema genérico de isomeria cis-trans em compostos cíclicos
Por exemplo, considere o exemplo a seguir do composto 1,2-dimetilciclopentano. Observe que um deles possui os dois ligantes iguais no mesmo lado do plano (destacados pelo traço vermelho), sendo designado como isômero cis. Já o outro composto possui os ligantes iguais em planos diferentes, sendo, portanto, o isômero trans:
Isômeros cis-1,2-dimetilciclopentano e trans-1,2-dimetilciclopentano
Existe outro sistema de designação da isomeria espacial, que é a isomeria E-Z. Esse sistema é usado no lugar da designação cis-trans em casos em que os ligantes dos dois átomos de carbono são diferentes uns dos outros.
Por exemplo, no caso acima, os ligantes dos dois carbonos eram diferentes entre si, mas iguais aos ligantes do outro carbono. Mas e se, no lugar de um dos átomos de hidrogênio ligados a um carbono, houvesse um grupo etil (CH3CH2)? Como faríamos para saber o tipo de isômero geométrico que ele é?
Que tipo de isomeria ocorre nesses compostos cíclicos?
O uso da nomenclatura cis-trans poderia ser ambíguo nesse caso, visto que somente os grupos metil são ligantes iguais entre os dois átomos de carbono. Por essa razão, utiliza-se o sistema E-Z, que funciona assim: determinam-se os ligantes de maior número atômico e eles são considerados os grupos iguais. Se eles estiverem do mesmo lado do plano, então temos o isômero Z, mas se estiverem de lados opostos, temos o isômero E.
No exemplo apresentado, o grupo de um carbono que é de maior número atômico é o grupo etil; já no outro carbono, é o grupo metil. Assim, temos:
Determinação da isomeria através do sistema E-Z
Viu como o uso da nomenclatura cis-trans geraria dúvidas? Os grupos ligantes iguais, isto é, os grupos metil, não foram utilizados como base para a determinação da isomeria.
* Isomeria óptica: Qualquer composto que possui estrutura assimétrica desvia o plano da luz polarizada e, consequentemente, realiza isomeria.
Vamos tomar como exemplo o 1,2 dicloropropano. Veja que, se traçarmos um plano de simetria no centro da molécula, o isômero trans será assimétrico e o isômero cis será simétrico:
Traçando plano de simetria em moléculas do 1,2-dicloropropano
Assim, temos que, visto que o isômero cis não possui cadeia assimétrica, ele não desvia o plano de luz polarizada, sendo opticamente inativo. Já o isômero trans é opticamente ativo, aparecendo na forma de levogiro, dextrogiro e uma mistura racêmica.



