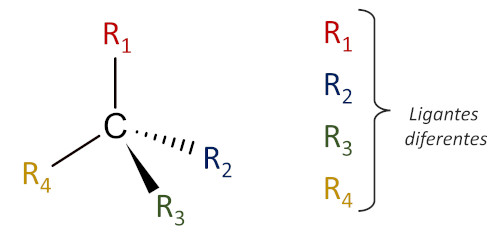
Carbono quiral
O carbono quiral é caracterizado como um átomo de carbono que estabelece apenas ligações simples com quatro grupos químicos (ligantes) diferentes. Carbonos quirais também são conhecidos como carbonos assimétricos, pelo fato de moléculas quirais não apresentarem plano de simetria. A identificação de carbonos quirais deve ser feita analisando cada ligante unido ao carbono como um todo, tanto em moléculas lineares como em moléculas cíclicas.
A isomeria óptica apenas se manifesta em moléculas que possuem centros quirais, pois a disposição espacial dos ligantes ao redor do átomo de carbono é responsável pelo diferente desvio da luz polarizada e por diferentes atividades fisiológicas. A análise de presença de carbonos quirais é muito importante na indústria farmacêutica, pois define a atividade de fármacos.
Leia também: Quais são os tipos de isomeria?
Resumo sobre carbono quiral
- Carbonos quirais são átomos de carbono que estabelecem apenas ligações simples com quatro ligantes diferentes.
- Carbonos quirais possuem hibridização sp3 e geometria tetraédrica.
- Carbonos quirais também são chamados de carbonos assimétricos.
- Centros quirais são identificados pela análise de todo o ligante unido ao átomo de carbono.
- Centros assimétricos existem em moléculas lineares e cíclicas.
- A isomeria óptica ocorre em razão da presença de carbonos quirais.
- Os isômeros ópticos se diferenciam pelo desvio da luz polarizada e pela atividade fisiológica.
- A diferença na atuação fisiológica é um ponto determinante para o funcionamento adequado de fármacos.
O que é carbono quiral?
Carbono quiral é um átomo de carbono que realiza quatro ligações simples com ligantes diferentes.
Carbonos quirais sempre possuem hibridização sp3, pois estabelecem apenas ligações simples, adotando uma geometria tetraédrica em relação ao arranjo espacial dos ligantes em torno do átomo de carbono.
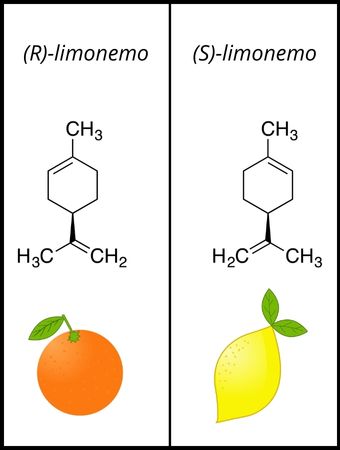
O termo “quiral” vem da propriedade de quiralidade e é muito empregado na área de química orgânica para se referir às moléculas que não se sobrepõem às suas imagens especulares, formadas no espelho. Por isso, carbonos quirais também são conhecidos como carbonos assimétricos, uma vez que moléculas quirais não possuem plano de simetria.
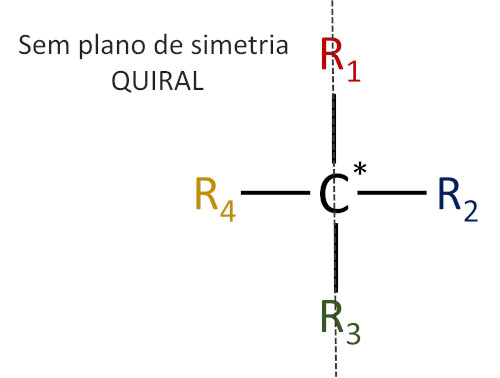
Para que uma molécula seja classificada como quiral, basta que possua um único centro quiral, isto é, um átomo de carbono quiral.
É comum a presença de um asterisco (*) ao lado de carbonos quirais no desenho de moléculas, principalmente em moléculas orgânicas grandes.
Como identificar o carbono quiral?
Para identificar se um carbono é quiral, é necessário observar a presença de apenas ligações simples e analisar a natureza dos ligantes, os quais devem ser todos diferentes entre si. Carbonos quirais são encontrados em moléculas lineares e em moléculas cíclicas (fechadas).
→ Carbono quiral em cadeia aberta
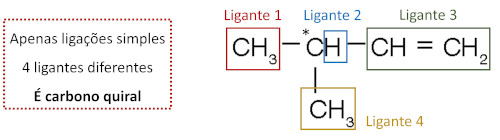
Em cadeias abertas ou lineares, a análise de carbono quiral deve ser feita com base no tipo de ligante de cada átomo de carbono. Veja como fazer isso para a molécula do 3-metil-1-penteno.
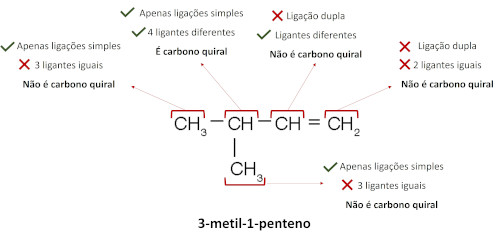
Perceba que, dos cinco átomos de carbono presentes na molécula, apenas um deles possui os atributos necessários para ser caracterizado como carbono quiral. Na ilustração abaixo, o carbono quiral está sinalizado com asterisco, e seus ligantes diferentes estão destacados pelas caixas coloridas. Ao analisar o ligante, considere-o como um todo e não apenas o átomo ligado diretamente ao átomo de carbono.
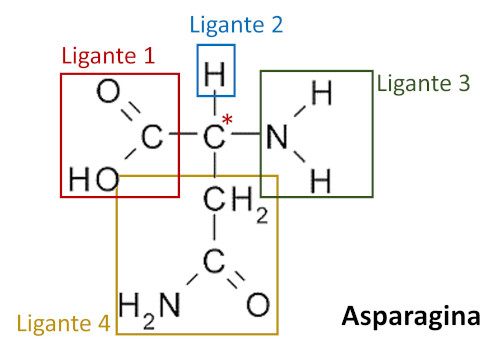
O aminoácido asparagina possui uma molécula quiral em razão da presença de um único carbono quiral. Identificamos o carbono quiral pelo fato de ele estar ligado a quatro ligantes diferentes, conforme destacado na imagem abaixo:
Veja outro exemplo para a molécula de ácido 9-hidroxidec-2-enoico, um tipo de feromônio produzido por abelhas.
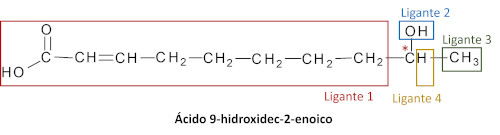
Note que, apesar de muitos átomos de carbono nessa molécula, apenas um deles apresenta quiralidade.
→ Carbono quiral em cadeia fechada
Cadeias fechadas ou cíclicas também podem apresentar carbono quiral. Nesse tipo de estrutura, a identificação do carbono assimétrico também é realizada com base nos átomos de carbono saturados e com quatro ligantes distintos, mas com atenção especial ao grupo de átomos ligado diretamente ao carbono quiral.
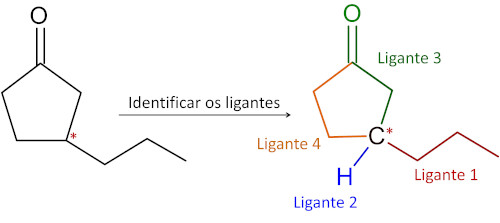
Abaixo são apresentadas a molécula do ibuprofeno e a identificação de seu carbono quiral, identificado por estar unido a quatro ligantes diferentes.
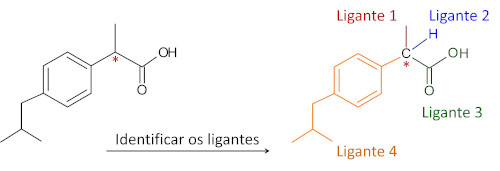
Qual a importância do carbono quiral?
A identificação do carbono quiral é importante porque moléculas quirais manifestam isomeria óptica.
A isomeria é um fenômeno que se refere à existência de moléculas com similares fórmulas moleculares e propriedades químicas e físicas diferentes, chamadas isômeros. No caso da isomeria óptica, os isômeros possuem apenas duas propriedades distintas:
- desviam o plano da luz polarizada em sentidos opostos;
- possuem atividades fisiológicas diferentes.
A característica de possuir atividades fisiológicas diferentes significa que os isômeros podem interagir de diferentes formas com sistemas biológicos. Isso é especialmente relevante para a atividade de fármacos que possuem centros quirais, pois um dos isômeros pode atuar de acordo com a ação esperada do fármaco, enquanto outro pode apresentar toxicidade ou efeitos colaterais não aceitáveis.
Um dos casos mais famosos de ações biológicas distintas em fármacos isômeros é o da talidomida, medicamento utilizado no tratamento de enjoos em gestantes nos anos 1950. No entanto, o que não se sabia à época era que a molécula do princípio ativo da talidomida possuía dois isômeros ópticos. Um deles promovia o efeito esperado nas pacientes, enquanto o outro possuía ação teratogênica, causando má-formação nos fetos. Infelizmente, isso foi descoberto somente após diversos casos de bebês nascidos com má-formação.
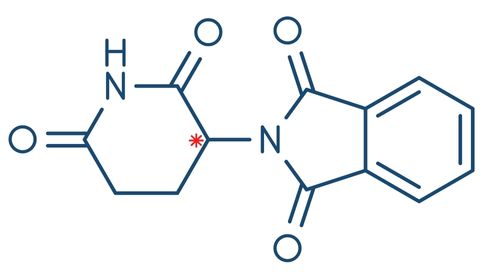
Atualmente, as indústrias farmacêuticas mantêm um rigoroso controle de pesquisa e fabricação dos medicamentos que possuem centros quirais para que casos como esse não aconteçam novamente.
Saiba mais: Alotropia do carbono — a formação de diferentes substâncias por meio da união de vários átomos de carbono
Exercícios resolvidos sobre carbono quiral
Questão 1
(UFF) Algumas substâncias têm a propriedade de desviar o plano de vibração da luz polarizada e são denominadas oticamente ativas. Esta propriedade caracteriza os compostos que apresentam isomeria ótica. A condição necessária para a ocorrência de isomeria ótica é que a substância apresente assimetria.
Considere as representações espaciais das estruturas a seguir:
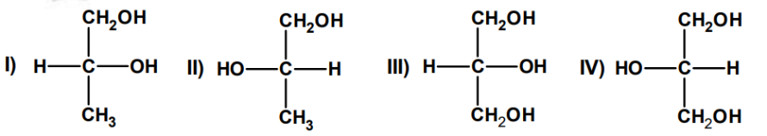
Em relação às estruturas I, II, III e IV, afirma-se corretamente:
A) todas apresentam atividade ótica.
B) somente a I e a II apresentam atividade ótica.
C) somente a I e a III apresentam atividade ótica.
D) somente a III e a IV apresentam atividade ótica.
E) somente a II e a IV apresentam atividade ótica.
Resolução:
Alternativa B
Pela forma de representação das estruturas químicas, torna-se fácil identificar as moléculas que possuem carbono quiral. Carbono quiral é aquele átomo que estabelece apenas ligações simples e possui quatro ligantes diferentes.
Baseado nisso, entre as moléculas apresentadas, apenas I e II possuem carbono quiral. As moléculas III e IV possuem dois ligantes repetidos, o grupamento CH2OH, não constituindo carbono quiral.
Questão 2
(Univag) Considere a representação da estrutura do ácido glutâmico, um aminoácido não essencial. Nessa representação, os átomos de carbono estão identificados por números.
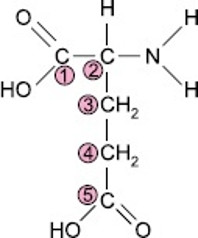
O átomo de carbono assimétrico da molécula do ácido glutâmico é o identificado pelo número:
A) 3
B) 1
C) 5
D) 2
E) 4
Resolução:
Alternativa D
As condições para que um átomo seja considerado quiral são possuir apenas ligações simples e ter quatro ligantes diferentes:
- Os carbonos 1 e 5 possuem dupla ligação, logo, não são quirais.
- O carbono 2 forma apenas ligações simples e possui quatros ligantes diferentes, logo, é centro quiral ou assimétrico.
- Os carbonos 3 e 4 possuem dois ligantes hidrogênio iguais, logo, não são quirais.
Ferramentas Brasil Escola
Artigos Relacionados

Últimas notícias
Outras matérias


















