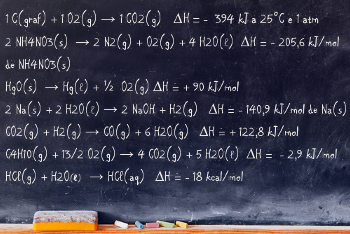Equações Termoquímicas
As equações termoquímicas são uma forma de representar os aspectos quantitativos e qualitativos das reações químicas ou processos físicos que envolvem trocas de calor. Em uma equação termoquímica devemos indicar os seguintes aspectos:
1- Substâncias que reagem do lado esquerdo da seta e substâncias que são produzidas do lado direito da seta. Cada substância deve vir acompanhada do seu respectivo coeficiente estequiométrico, que indica a quantidade de matéria, isto é, o número de mols de reagentes e produtos. Isso significa que a equação deve estar devidamente balanceada;
2- A equação termoquímica deve apresentar a quantidade de calor que foi perdida ou absorvida. Esse “calor de reação” é indicado pela variação da entalpia, que é simbolizada por ΔH. Os valores das variações de entalpia são exclusivos para cada reação e costumam ser determinados experimentalmente. Podemos dizer que esse é o aspecto mais importante que deve aparecer nas equações termoquímicas, que ficam com o seguinte esquema:
Reagentes → Produtos ΔH = Energia (em kJ/mol)
Por exemplo, para que 1 mol de água sólida sofra fusão, ou seja, passe do estado sólido para o líquido, é preciso que ela absorva 7,3 kJ, o que poderia ser expresso da seguinte forma:
H2O(s) + 7,3 kJ → H2O(l)
Mas a equação termoquímica desse processo é expressa da seguinte maneira:
H2O(s) → H2O(l) ΔH = + 7,3 kJ
É interessante observar que o processo contrário, que é a solidificação (passagem da água líquida para o estado sólido), ocorre com a liberação dessa mesma quantidade de energia. Esse processo é expresso da seguinte forma:
H2O(l) → H2O(s) ΔH = - 7,3 kJ
Isso nos informa três aspectos importantes que precisamos saber sobre as equações termoquímicas:
2.1 - Se o valor da variação da entalpia é positivo (ΔH > 0), a reação é endotérmica, ou seja, ocorre com absorção de calor. Mas se o valor da variação da entalpia é negativo (ΔH < 0), a reação é exotérmica, ou seja, ocorre com liberação de calor.
2.2 - Quando escrevemos uma equação termoquímica, precisamos indicar a fase de agregação ou estado físico em que se encontram as substâncias participantes da reação. Isso é indicado pelos seguintes símbolos que aparecem subscritos no lado direito da substância:
sólido: (s);
líquido: (l);
gasoso: (g);
vapor: (v);
solução aquosa: (aq).
É preciso indicar também a estrutura cristalina ou variedade alotrópica*. Por exemplo: C(grafite), C(diamante), S8(monoclínico) e S8(rômbico).
2.3 - Se invertermos a equação, precisamos inverter também o sinal da variação da entalpia.
3 - Visto que o ΔH varia em função da temperatura e da pressão, é preciso também indicar em quais condições a reação ocorreu. Se essas informações não aparecerem na equação termoquímica, é porque os valores de ΔH foram medidos nas condições-padrão, ou seja, na temperatura de 25ºC (298 K) e à pressão de 1 atm.
4 - Se aumentarmos ou diminuirmos a quantidade de matéria (mol) dos reagentes, isso não só afetará proporcionalmente a quantidade de matéria dos produtos formados, mas também a quantidade de energia que foi liberada ou absorvida na reação, ou seja, o valor de ΔH.
Por exemplo, considere a reação de formação de 1 mol de gás carbônico a partir de 1 mol de grafita com 1 mol de gás oxigênio e liberação de 394 kJ de energia. A equação termoquímica que representa essa reação química é dada por:
1 C(graf) + 1 O2(g) → 1 CO2(g) ΔH = - 394 kJ a 25ºC e 1 atm
Se dobrarmos as quantidades de reagentes dessa reação, será formado o dobro de produto e também será liberado o dobro de energia:
2 C(graf) + 2 O2(g) → 2 CO2(g) ΔH = - 788 kJ (ou seja, -394 . 2 kJ)
Mas também podemos representar essa equação da seguinte forma:
2 C(graf) + 2 O2(g) → 2 CO2(g) ΔH = - 394 kJ/mol
Observe que o valor de ΔH foi dado em kJ por mol, ou seja, é a energia liberada quando apenas 1 mol reage. Veja mais um exemplo:
Considere a seguinte reação:
2 NH4NO3(s) - 411,2 kJ → 2 N2(g) + O2(g) + 4 H2O(l)
A equação termoquímica que representa essa equação pode ser expressa por:
2 NH4NO3(s) → 2 N2(g) + O2(g) + 4 H2O(l) ΔH = - 205,6 kJ/mol de NH4NO3(s)
Quando 2 mol de NH4NO3(s) reagiram, foram liberados 411,2 kJ de energia. Então, para 1 mol de NH4NO3(s), será liberada a metade de 411,2, isto é, 205,6.
Por outro lado, se reduzirmos a quantidade de matéria dos reagentes à metade, os produtos e a energia liberada também diminuirão proporcionalmente:
½ C(graf) + ½ O2(g) → ½ CO2(g) ΔH = - 197 kJ (ou seja, -394 . ½ kJ)
ou
½ C(graf) + ½ O2(g) → ½ CO2(g) ΔH = -394 kJ/mol
5 - Quando todos os participantes de uma reação estão no estado padrão, ou seja, na forma alotrópica mais estável, a 1 atm e a 25ºC, a variação de entalpia é indicada por ΔH0 (variação de entalpia-padrão).
* Para tirar quaisquer dúvidas sobre variedades alotrópicas, leia o texto Alotropia.