Moléculas apolares
Moléculas apolares são todos os aglomerados de átomos, formados a partir de ligações covalentes, que não apresentam polos positivo e negativo, como são os encontrados nas moléculas polares.
De uma forma geral, as moléculas apolares apresentam as seguintes características:
-
Interagem entre si por forças de london ou dipolo induzido;
-
Apresentam o vetor momento dipolar sempre igual a zero;
-
Tendem a apresentar uma maior solubilidade em outros compostos cujas moléculas são apolares.
A partir dessas características, é fundamental saber determinar se uma substância específica é formada ou não por moléculas apolares. Para isso, podemos levar em consideração dois critérios de determinação, que dependem obrigatoriamente da fórmula estrutural da molécula:
1- Determinação de uma molécula apolar a partir do número de nuvens e ligantes
Podemos determinar se uma molécula é apolar a partir da comparação entre o número de nuvens eletrônicas presente no átomo central e os átomos que estão ligados a ele.
A molécula será apolar sempre que o número de nuvens eletrônicas for exatamente igual ao número de ligantes iguais no átomo central, como podemos acompanhar em cada um dos casos a seguir:
Obs.: Denomina-se nuvem eletrônica todo tipo de ligação entre átomos e par de elétrons que não participam de ligações.
1º Exemplo: Gás carbônico
.jpg)
Fórmula estrutural do gás carbônico
Essa molécula apresenta:
-
Duas nuvens eletrônicas no átomo central referentes a ligações (duas ligações duplas);
-
Dois ligantes iguais (dois átomos de oxigênio) no átomo central.
Obs.: O carbono não apresenta elétrons não ligantes porque em sua camada de valência existem quatro elétrons, os quais estão sendo utilizados nas duas ligações duplas.
2º Exemplo: Gás metano
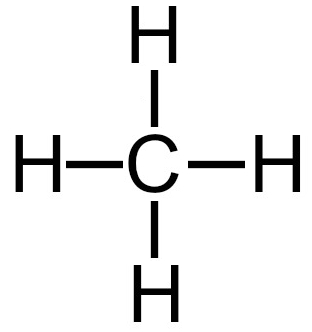
Fórmula estrutural do gás metano
A molécula do gás metano apresenta:
-
Quatro nuvens eletrônicas no átomo central referentes a ligações (quatro ligações simples);
-
Quatro ligantes iguais (quatro átomos de hidrogênio) no átomo central.
Obs.: O carbono não apresenta elétrons não ligantes porque em sua camada de valência existem quatro elétrons, que estão sendo utilizados nas quatro ligações simples.
3º Exemplo: Trióxido de enxofre
.jpg)
Fórmula estrutural do trióxido de enxofre
Essa molécula apresenta:
-
Três nuvens eletrônicas no átomo central referentes a ligações (três ligações duplas);
-
Três ligantes iguais (três átomos de oxigênio) no átomo central.
Obs.: O enxofre não apresenta elétrons não ligantes porque em sua camada de valência existem seis elétrons, os quais estão sendo utilizados na ligação dupla e nas ligações coordenadas dativas.
4º Exemplo: Tricloreto de boro
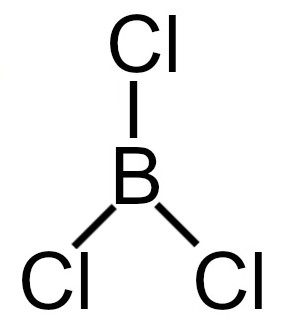
Fórmula estrutural do tricloreto de boro
A molécula do tricloreto de boro apresenta:
-
Três nuvens eletrônicas no átomo central referentes a ligações (três ligações simples);
-
Três ligantes iguais (três átomos de cloro) no átomo central.
Obs.: O boro não apresenta elétrons não ligantes porque em sua camada de valência existem três elétrons, que estão sendo utilizados nas três ligações simples.
2- Determinação de uma molécula apolar a partir do vetor momento dipolar resultante
Um vetor momento dipolar ocorre quando um átomo é mais eletronegativo que outro em uma ligação. A sequência a seguir indica a ordem decrescente de eletronegatividade entre os elementos:
F>O>N>Cl>Br>I>S>C>P>H
A molécula será apolar sempre que a somatória dos vetores momento dipolar entre os átomos for igual a zero.
1º Exemplos: Vetores no gás carbônico
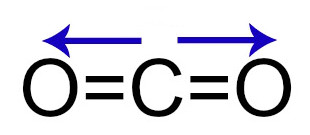
Demonstração dos vetores dipolares no gás carbônico
Nessa molécula, temos vetores momento dipolar:
-
1 vetor do carbono em direção ao oxigênio (à esquerda);
-
1 vetor do carbono em direção ao oxigênio (à direita).
Os vetores dessa molécula são anulados porque estão dispostos na mesma direção (horizontal) e em sentidos diferentes (direita e esquerda).
2º Exemplos: Vetores no gás metano
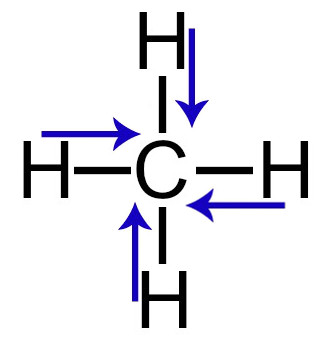
Demonstração dos vetores dipolares no gás metano
Nessa molécula, temos os seguintes vetores momento dipolar:
-
1 vetor do carbono em direção ao hidrogênio (à esquerda);
-
1 vetor do carbono em direção ao hidrogênio (à direita);
-
1 vetor do carbono em direção ao hidrogênio (para cima);
-
1 vetor do carbono em direção ao hidrogênio (para baixo).
Os vetores que estão no sentido horizontal são anulados por apresentar sentidos diferentes (direita e esquerda), o que também ocorre com os vetores do sentido vertical (para cima e para baixo). Portanto, o vetor momento dipolar resultante dessa molécula será igual a zero.
3º Exemplos: Vetores no trióxido de enxofre
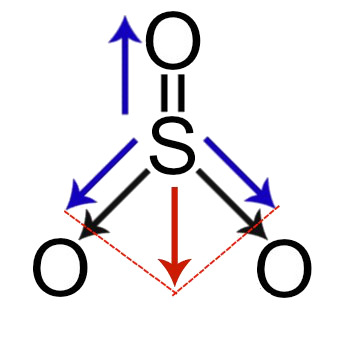
Demonstração dos vetores dipolares no trióxido de enxofre
Nessa molécula, temos os seguintes vetores momento dipolar:
-
1 vetor do enxofre em direção ao oxigênio (para diagonal direita);
-
1 vetor do enxofre em direção ao oxigênio (para diagonal esquerda);
-
1 vetor do enxofre em direção ao oxigênio (para cima).
Obs.: Os vetores da diagonal devem ser decompostos, segundo a regra do paralelogramo. De acordo com essa regra, ao ligar as pontas dos vetores (tracejado vermelho), surge um vetor resultante (seta vermelha).
Assim, na realidade, temos na molécula um vetor para cima e um para baixo, os quais são anulados.
4º Exemplos: Vetores no tricloreto de boro
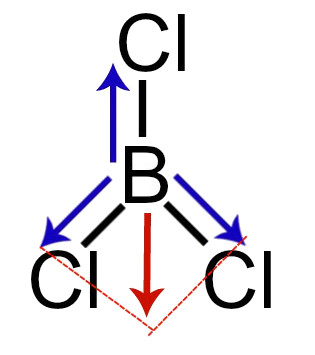
Demonstração dos vetores dipolares no tricloreto de boro
Nessa molécula, temos os seguintes vetores momento dipolar:
-
1 vetor do boro em direção ao cloro (para diagonal direita);
-
1 vetor do boro em direção ao cloro (para diagonal esquerda);
-
1 vetor do boro em direção ao cloro (para cima).
Obs.: Os vetores da diagonal devem ser decompostos segundo a regra do paralelogramo. Conforme essa regra, ao ligar as pontas dos vetores (tracejado vermelho), surge um vetor resultante (seta vermelha).
Portanto, na realidade, nessa molécula, temos um vetor para cima e um para baixo, os quais são anulados.

Videoaulas
Artigos Relacionados
Clique e entenda passo a passo como ocorre a hibridização do boro e por que ela é conhecida como hibridização do tipo sp2.
