Tonoscopia
Tonoscopia é uma das quatro propriedades coligativas (juntamente com ebulioscopia, crioscopia e osmoscopia) que ocorrem quando um soluto não volátil é adicionado e dissolvido em um determinado solvente.
No caso específico da tonoscopia, essa propriedade estuda a diminuição da pressão máxima de vapor de um solvente após a adição do soluto não volátil. Assim, antes de mais nada, é importante conhecer o que é a pressão máxima de vapor.
Pressão máxima de vapor
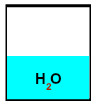
Imagine, por exemplo, um recipiente fechado que contém água:
No interior desse recipiente, a água evapora, pois as paredes dele não impedem a troca de energia entre a água e o meio externo. À medida que o tempo passa, a região entre a superfície da água e as paredes saturam de moléculas de água na forma de vapor. A pressão exercida por essas moléculas nas paredes é denominada pressão máxima de vapor.
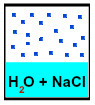
Recipiente saturado com moléculas de água
A partir disso, inicia-se um equilíbrio dinâmico, pois, a cada molécula de água que passa para o estado de vapor, uma outra passa para o estado líquido:

Equilíbrio dinâmico entre estado vapor e líquido
Quanto menor for o ponto de ebulição do líquido, mais rápido ele evapora, e mais rapidamente ele atingirá a pressão máxima de vapor. Isso significa que, quanto menor o ponto de ebulição do solvente, mais moléculas no estado de vapor, portanto, maior será a pressão máxima de vapor.
No gráfico abaixo, temos pressão máxima de vapor no eixo y, a temperatura no eixo x, e as curvas de três líquidos diferentes:
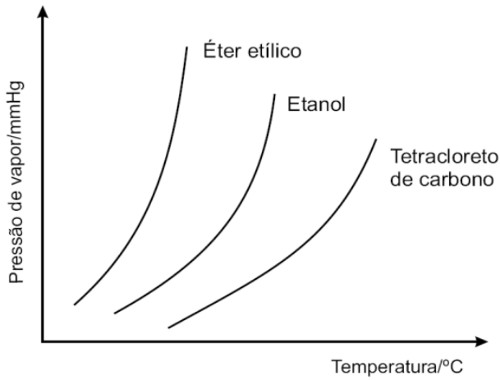
Gráfico de três solventes diferentes
Quanto mais próximo do eixo y, maior a pressão de vapor, e menor o ponto de ebulição. Portanto, dos três solventes desse gráfico, o de maior pressão máxima de vapor é o éter etílico.
Tonoscopia
Após compreender o que é a pressão máxima de vapor, podemos entender a tonoscopia. Quando adicionamos um soluto não volátil a um solvente, ao dissolver-se, o soluto eleva o ponto de ebulição do solvente (devido à interação entre as partículas), diminuindo, consequentemente, a pressão máxima de vapor.
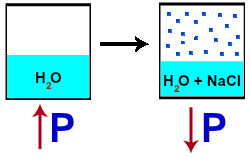
Comparando a pressão entre o solvente e a solução
Graficamente, a curva da solução (B) é sempre mais afastada do eixo y do que a curva do solvente (A), confirmando a redução da pressão máxima de vapor do solvente
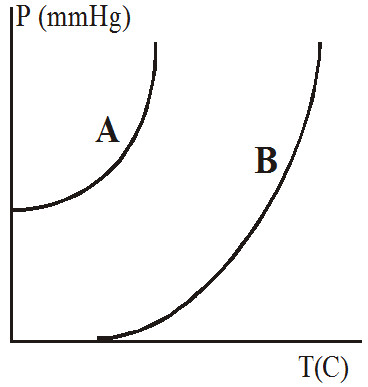
Gráfico com as curvas do solvente e da solução com esse solvente
Tipos de solutos
Existem dois tipos de solutos que podem ser adicionados ao solvente, sendo que o efeito tonoscópico promovido por eles não é o mesmo:
-
Soluto molecular
É o soluto que não sofre ionização ou dissociação ao dissolver-se. Por causa disso, o número de partículas adicionado é igual ao número de moléculas dissolvidas.
-
Soluto iônico
É o soluto que sofre ionização ou dissociação ao dissolver-se. Em razão disso, o número de partículas adicionado é menor que o número de partículas dissolvidas.
Pelo exposto neste texto, podemos concluir que, se o soluto for iônico, o efeito tonoscópico promovido no solvente será maior, ou seja, menor será a pressão máxima de vapor.
Observação: O grau de ionização e o número de íons que compõem o soluto iônico também influenciam diretamente no efeito tonoscópico. Assim, quanto maior o grau ou o número de íons, maior o efeito tonoscópico.