Bases
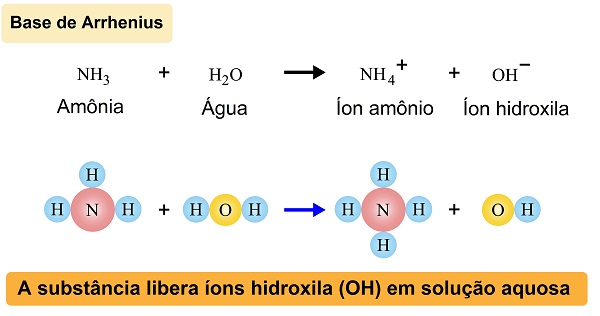
As bases são, de acordo com a química clássica, que será a fundamentação deste texto, todas as substâncias que liberam íons (OH-) em meio aquoso. Essa é a definição proposta por Arrhenius, que ainda considera que as substâncias com pH maior do que 7 são consideradas alcalinas, ou de caráter básico, ou seja, possuem uma alta concentração de íons OH-.
Elas são formadas em sua maioria por íons metálicos, e o critério que determina sua força e solubilidade é o metal formador. O prefixo hidroxila indica que o composto a que se refere é uma base, a nomenclatura é estruturada pelo nome do elemento central + carga, quando variável.
As bases são responsáveis pelo sabor adstringente da banana verde, são aplicadas industrialmente na produção de fármacos, saneantes, fertilizantes entre outros produtos químicos.
O que é base?
A primeira forma utilizada para caracterizar a basicidade ou acidez de uma substância foi o indicador azul de tornassol, que adquire coloração azul para soluções com pH alto (bases) e coloração vermelha em soluções com pH baixo (ácido).
Foi Svante Arrhenius, em 1887, quem propôs a definição aceita pela química clássica que descreve o que é uma base. De acordo com ele, base é toda molécula que em solução aquosa libera o íon hidróxido, ou hidroxila (OH-).
Em 1923, os químicos Johannes Nicolaus Brønsted e Thomas Martin Lowryem, em estudos distintos, definiram base como espécies químicas capazes de receber prótons. Essa definição, diferentemente da teoria de Arrhenius, inclui substâncias que não estão em meio aquoso.
No mesmo ano, o cientista Gilbert Lewis propôs uma outra definição para bases e ácidos, desvinculando-se da ideia de doar ou receber prótons. Lewis afirma que base é toda substância capaz de ceder um par de elétrons livres, o que acontece no caso de ocorrer a expansão da valência do átomo central da molécula (ligação covalente dativa).
Porém, neste texto, vamos desenvolver características, exemplos e nomenclatura para bases de acordo com a definição de Arrhenius.
Leia também: Teorias ácido-base de Arrhenius, de Brønsted-Lowry e de Lewis
Característica das bases
-
Solução aquosa, ou solução alcalina, tem pH maior do que 7, em condições normais de temperatura e pressão.
-
Soluções alcalinas são condutoras de eletricidade.
-
Bases são formadas por um cátion metálico ligado ionicamente a uma hidroxila (OH-), com exceção do hidróxido de amônia (NH4OH).
-
As bases, em geral, são adstringentes.
-
A solubilidade das bases varia conforme o elemento formador: nitrogênio e metais alcalinos formam bases solúveis, metais alcalinos terrosos, com exceção do magnésio, formam bases pouco solúveis, e os metais de transição formam bases insolúveis.
Classificação das bases
As bases podem ser classificadas de acordo com o número de hidroxilas (OH-) que contem na molécula:
-
Monobases: 1 hidroxila (OH-)
-
Dibases: 2 hidroxilas (OH-)
-
Tribases: 3 hidroxilas (OH-)
-
Tetrabases: 4 hidroxilas (OH-)
Outra classificação diz respeito ao grau de dissociação.
-
Base forte: é aquela que em meio aquoso protona, ou dissocia muito, ou seja, a maior parte das suas moléculas dividem-se entre íons: ânions e cátions, para assim formar outras moléculas. As bases fortes são formadas por elementos da família IA e IIA, com exceção do berílio (Be) e o magnésio (Mg).
-
Base fraca: é aquela não dissocia tanto quando está em meio aquoso. As bases fracas são formadas pelos metais de transição e o nitrogênio (N), que forma o hidróxido de amônio.
Hidróxido de magnésio (Mg(OH)2), também conhecido como leite de magnésio, usado como antiácido, fármaco para tratamento de estomatites, pode ser classificado como um diácido forte, pois possui duas hidroxilas e alto grau de dissociação entre os íons formadores da molécula.
Veja também: Você sabe o que significa pH?
Nomenclatura das bases
Para bases monovalentes, cujo o elemento central tenha apenas um Nox (número de oxidação), a nomenclatura será dada por: hidróxido de + nome do elemento.
Exemplos
-
Hidróxido de alumínio = Al(OH)3
-
Hidróxido de prata = AgOH
-
Hidróxido de Sódio = NaOH
Para bases em que o metal tem carga variável, indica-se ao final, em números romanos, a carga do cátion. Podem ser usados também os sufixos -ico para carga maior e -oso para carga menor. Ficando então da seguinte forma:
Hidróxido + elemento + n° da carga ou sufixo respectivo a carga (-ico↑, -oso↓)
Exemplo:
O ferro pode ter carga Fe2+ ou Fe3+ que formarão as bases Fe(OH)2 e Fe(OH)3. Veja como fica a nomenclatura de cada uma:
Fe(OH)2 → Hidróxido de Ferro II ou hidróxido ferroso
Fe(OH)3 → Hidróxido de Ferro III ou hidróxido férrico
Principais bases
-
NaOH: Hidróxido de sódio
-
Ca(OH)2: Hidróxido de cálcio
-
Mg(OH)2:Hidróxido de magnésio
-
NH4OH: Hidróxido de amônio
-
KOH: Hidróxido de potássio
-
Ba(OH)2: Hidróxido de bário
-
Al(OH)3: Hidróxido de alumínio
-
Zn(OH)2: Hidróxido de zinco
-
AgOH: Hidróxido de prata
-
Fe(OH)2 e Fe(OH)3: Hidróxido ferroso e férrico.
-
Ni(OH)2: Hidróxido de níquel
Acesse também: Conceito de ácido, base e sal pela teoria de Arrhenius
Bases no cotidiano
As bases são substâncias presentes em nosso dia a dia, pois estão agregadas a produtos de limpeza, alimentos e fármacos. Frutas que apresentam sabor amargo, adstringente, como a banana verde, possuem em sua estrutura uma molécula alcalina, nesse caso é o hidróxido de alumínio (Al(OH)3).
Outra base muito comum e utilizada para fabricar sabão caseiro é o hidróxido de sódio (NaOH), conhecido também como soda cáustica, uma base forte que apresenta riscos à saúde se não for manipulada corretamente.
É importante citar também o hidróxido de amônio (NH4OH), que é uma base fraca, porém corrosiva, proveniente da solubilização de amônia (NH4) em água. O hidróxido de amônio possui diversas aplicações, é usado na produção de alisantes para cabelo, produtos de limpeza e gás de refrigeração, fertilizantes agrícolas e até explosivos.
Exercícios resolvidos
Questão 1 - (CEFET MG 2008 - Adaptada ) Todos os compostos a seguir, ao serem colocados em água, formam base de Arrhenius, EXCETO:
a) Na(s)
b) NH3(l)
c) MgO(s)
d) SO3(g)
e) FeO
Resolução
Alternativa D. A substância SO3 ao se solubilizar em água forma ácido sulfúrico (H2SO4).
Questão 2 - (Unioeste 2012) - Os hidróxidos de sódio, cálcio, alumínio e magnésio são bases utilizadas com diferentes números de hidroxilas. Assinale a alternativa que define corretamente essas bases na sequência indicada.
a) Monobase, dibase, dibase e monobase.
b) Monobase, monobase, tribase e dibase.
c) Dibase, dibase, tribase e dibase.
d) Tribase, monobase, monobase e monobase.
e) Monobase, dibase, tribase e dibase.
Resolução
Alternativa E. Para descobrir quantas hidroxilas cada base carrega, é necessário saber a fórmula molecular de cada composto. Para isso, faremos uma análise do metal formador da base, no caso do hidróxido de sódio, o sódio é um metal alcalino, do grupo 1, de acordo com a regra do octeto, metais da família 1A admitem a perda de um elétron, teremos portanto 1 (OH-) hidroxila ligada a esse metal. Seguindo a mesma regra para as demais bases teremos:
Hidróxido de sódio: NaOH – Monobase
Hidróxido de cálcio: Ca(OH)2 - Dibase
Hidróxido de alumínio: Al(OH)3 - Tribase
Hidróxido de magnésio: Mg(OH)2 – Dibase
Questão 3 - Identifique a alternativa que apresenta dois produtos caseiros com propriedades alcalinas básicas:
a) detergente e vinagre.
b) sal e coalhada.
c) leite de magnésio e sabão.
d) bicarbonato e açúcar.
e) Coca-cola e água de cal.
Resolução
Alternativa C. O leite de magnésio é um fármaco que tem como base o hidróxido de magnésio, usado para tratar acidez estomacal, e o sabão tem em sua formulação o hidróxido de sódio, base forte e corrosiva, utilizado na fabricação de detergentes em geral por ser um emoliente de gorduras.



