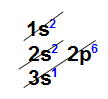Ligação Iônica

Ligação iônica é o nome dado a uma das três formas como os átomos podem interagir entre si. As outras formas de interação entre átomos são a ligação covalente, que ocorre entre átomos de ametais, hidrogênios, ou ametal e hidrogênio, e a ligação metálica, a qual acontece somente entre átomos de um mesmo metal.
Os átomos dos elementos químicos que participam da ligação iônica devem apresentar, obrigatoriamente, a natureza de ganhar ou perder elétrons, assim, a ligação iônica pode ocorrer entre:
-
um metal e um ametal;
-
um metal e o hidrogênio.
As fórmulas dos compostos formados a partir de ligação iônica sempre apresentam um padrão YX, em que o Y sempre será o elemento metálico. Dessa forma, para identificar um composto iônico, basta verificar se a fórmula inicia com um elemento metálico.
Princípio da ligação iônica
Para um melhor entendimento de como ocorre uma ligação iônica, vamos utilizar a substância iônica mais conhecida entre nós, o cloreto de sódio (NaCl). Nesse composto iônico, estão os elementos:
-
Sódio: elemento metálico, pois possui característica de perder elétron; pertencente à família IA, de número atômico 11, com um elétron na camada de valência, como podemos observar na distribuição eletrônica abaixo:
Distribuição eletrônica do elemento sódio
A perda de elétron ocorre com relação aos elétrons que estão na camada de valência, logo, o átomo de sódio perde apenas um elétron. Com isso, ele passa a ter uma nova camada de valência, a segunda, que contém oito elétrons (obedecendo, assim, a regra do octeto).
Nova camada de valência do elemento sódio
-
Cloro: elemento ametálico, pois possui característica de ganhar elétron; pertencente à família VIIA, de número atômico 17, com sete elétrons na camada de valência, como podemos observar na distribuição eletrônica abaixo:
Distribuição eletrônica do elemento cloro
O ganho de elétron ocorre na camada de valência, dessa forma, o átomo de cloro ganha um elétron, pois falta apenas um para atingir a regra do octeto. Com isso, ele passa a ter oito elétrons na sua camada de valência.
Nova camada de valência do elemento cloro
Obs.: Assim, de uma forma geral, seguindo a regra do octeto, na ligação iônica, o metal, ao perder seus elétrons na camada de valência, torna-se estável, pois passará a ter uma nova camada de valência com dois (desde que seja no primeiro nível) ou oito elétrons. Com os ametais ou o hidrogênio não é diferente, pois, ao ganhar elétrons, passarão a ter dois ou oito elétrons na camada de valência.
Construção das fórmulas químicas dos compostos formados por ligação iônica
Para construir a fórmula de uma substância formada a partir da ligação iônica, devemos obedecer o seguinte padrão:
-
Determinar a carga do cátion;
-
Determinar a carga do ânion;
-
Cruzar as cargas, de forma que a carga do cátion seja o índice atômico (número à direita da sigla) do ânion, e vice-versa.
1º Exemplo: Fórmula com os elementos alumínio e bromo.
-
Alumínio: é um metal, por isso, tem a tendência de perder elétron; da família IIIA, pois possui três elétrons na camada de valência, logo, sua carga é +3;
-
Bromo: é um ametal, por isso, tem a tendência de ganhar elétron; da família VIIA, pois possui sete elétrons na camada de valência, logo, sua carga é -1;
-
O número 3, referente à carga do alumínio, será o índice do bromo, e o número 1, referente à carga do bromo, será o índice do alumínio.
Como a carga do alumínio é +3 e a do bromo é -1, assim, a fórmula do composto iônico será AlBr3.
2º Exemplo: Fórmula com os elementos magnésio e hidrogênio.
-
Magnésio é um metal, por isso, tem a tendência de perder elétron; da família IIA, pois possui dois elétrons na camada de valência, portanto, sua carga é +2;
-
Hidrogênio: não é ametal, porém, quando próximo a um metal, apresenta a tendência de ganhar elétron; não pertence a nenhuma família, pois possui um elétron na camada de valência. Assim, sua carga é -1;
-
O número 2, referente à carga do magnésio, será o índice do hidrogênio, e o número 1, referente à carga do hidrogênio, será o índice do magnésio.
Como a carga do magnésio é +2 e a do hidrogênio é -1, logo, a fórmula do composto iônico será MgH2.
Características dos compostos químicos formados por ligação iônica
De uma forma geral, os compostos iônicos, isto é, substâncias formadas mediante ligação iônica, apresentam as seguintes características:
-
São sólidos à temperatura ambiente;
-
Seus átomos organizam-se de uma maneira a produzir um retículo cristalino (um cristal).
Obs.: Nos compostos iônicos, os átomos aglomeram-se de forma a ocupar os vértices de estruturas cristalinas. No cloreto de sódio, por exemplo, um ânion cloreto (esfera roxa) interage ao mesmo tempo com seis cátions sódio (esferas verdes):
Representação da estrutura cristalina do cloreto de sódio
-
São solúveis em água;
-
São capazes de realizar o fenômeno da dissociação (liberação de íons) quando sofrem fusão, ou seja, quando passam do estado sólido para o estado líquido, ou quando estão dissolvidos em água;
-
Apresentam elevados pontos de fusão e de ebulição;
-
Possuem brilho;
-
Conduzem corrente quando dissolvidos em água ou após sofrerem o processo de fusão.