10 dicas fundamentais sobre reações inorgânicas para o Enem
A cada ano o número de estudantes que fazem a prova do Enem vem aumentando, já que a nota do exame é utilizada para ingresso em diversas universidades. Pensando em ampliar o conhecimento e facilitar a resolução de questões sobre reações químicas na prova de Ciências da Natureza, este texto traz 10 dicas fundamentais sobre reações inorgânicas para o Enem.
De uma forma geral, as reações inorgânicas são aquelas em que temos a presença de substâncias como ácidos, bases, sais e óxidos. Os produtos das reações estão diretamente relacionados com os reagentes utilizados, como veremos a seguir:
1ª Dica: Reações de neutralização
As reações de neutralização ocorrem quando um ácido interage com uma base, sendo o produto final sal e água. Veja um esquema geral de uma equação de neutralização:
HX + YOH → YX + H2O
Exemplos:
→ Neutralização entre ácido sulfúrico e hidróxido de sódio
H2SO4 + 2NaOH → Na2SO4 + 2H2O
→ Neutralização entre ácido fosfórico e hidróxido de magnésio
2H3PO4 + 3Mg(OH)2 → Mg3(PO4)2 + 6H2O
2ª Dica: Reações de simples troca
Na reação de simples troca, temos uma substância simples e uma substância composta no reagente de uma reação. Os produtos formados devem ser obrigatoriamente uma substância simples e outra composta.
Existem dois casos particulares de reações de simples troca, uma em que a substância simples é um ametal, e outra na qual a substância simples do reagente é um metal, como esquematizado nas equações a seguir:
X2 + YW → YX + W2 (Para ametal)
ou
Z + YW → ZW + Y (Para metal)
a) Simples troca entre metais
Nesse caso a substância simples é um metal que pode ou não trocar de posição com o metal presente na substância composta. Só teremos a troca entre os metais se o metal da substância simples for mais nobre que o metal da substância composta.
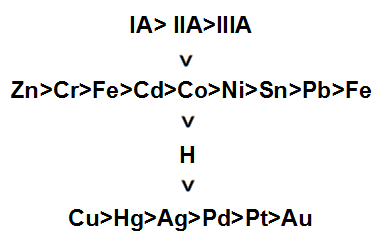
Esquema indicando a ordem de nobreza dos metais
Exemplo: Simples troca entre cobre e cloreto de cobre II
Zn + CuCl2 → ZnCl2 + Cu
O zinco troca de lugar com o cobre por ser mais nobre.
b) Simples troca entre ametais
Nesse caso, a substância simples é um ametal que pode ou não trocar de posição com o ametal presente na substância composta. Só teremos a troca entre os ametais se o ametal da substância simples for mais reativo que o ametal da substância composta.
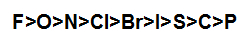
Esquema indicando a ordem decrescente de reatividade dos ametais
Exemplo: Simples troca entre cobre e cloreto de cobre II
F2 + CuCl2 → ZnF2 + Cl2
O flúor troca de lugar com o cloro por ser mais reativo.
3ª Dica: Reações de dupla troca
São reações químicas nas quais no reagente existem duas substâncias compostas que formam duas outras substâncias compostas. As possibilidades de reações de dupla troca são:
a) Dupla troca entre dois sais
Nesse tipo de dupla troca sempre teremos a formação de dois sais.
Exemplos:
NaCl + KI → NaI + KCl
MgCO3 + Cr(NO3)2 → Mg(NO3)2 + CrCO3
b) Dupla troca entre sal e base
Nesse tipo de dupla troca, sempre teremos a formação de um sal e de uma base.
Exemplos:
NaCl + KOH → KCl + NaOH
FeSO4 + Mg(OH)2 → MgSO4 + Fe(OH)2
c) dupla troca entre sal e ácido
Nesse tipo de dupla troca, sempre teremos a formação de um sal e de um ácido.
Exemplos:
H2SO4 + 2KI → K2SO4 + 2HI
3HCl + AlBr3 → AlCl3 + 3HBr
4ª Dica: Formação de ácidos a partir de óxidos ácidos
Os óxidos ácidos são formados por ametais ligados ao oxigênio. A exceção é o metal crômio, que forma o óxido ácido de fórmula CrO3. Alguns exemplos de óxidos ácidos são CO2, SO3, SO2 e P2O5.
Um ácido pode ser formado quando um óxido ácido reage com a água, de acordo com a equação abaixo:
DO + H2O → H2DO3
Veja alguns exemplos de equações que representam a formação de ácidos a partir de óxidos ácidos:
SO2 + H2O → H2SO3
CrO3 + H2O → H2CrO4
5ª Dica: Formação de óxidos básicos
Os óxidos básicos são formados por metais ligados ao oxigênio, mas existem metais que não formam óxidos básicos, como é o caso do Al, Pb, Zn e Sn. Alguns exemplos de óxidos básicos são CaO, Na2O, MgO, FeO.
Uma base pode ser formada quando um óxido básico reage com água, de acordo com a equação a seguir:
YO + H2O → YOH
OBS.: Pode ser que a equação deva ser balanceada.
Veja alguns exemplos de equações que representam a formação de bases a partir de óxidos básicos:
CaO + H2O → Ca(OH)2
Na2O + H2O → 2NaOH
6ª Dica: Reação entre óxidos ácidos e óxidos básicos
Quando óxidos ácidos reagem com óxidos básicos, temos a formação de um sal (sendo o ânion desse sal obrigatoriamente oxigenado).
DO + YO → YDO
Exemplo: Reação entre o dióxido de carbono e o óxido de sódio
CO2 + Na2O → Na2CO3
7ª Dica: Reação entre óxidos ácidos e bases
Quando óxidos ácidos reagem com bases, temos uma reação de neutralização, já que os produtos formados nesse processo são sal e água, como podemos observar na equação geral abaixo:
DO + YOH → YDO + H2O
Exemplo: Reação entre o dióxido de carbono e o hidróxido de sódio
CO2 + 2 NaOH → Na2CO3 + H2O
8ª Dica: Reação entre ácidos e óxidos básicos
Quando óxidos básicos reagem com ácidos, temos uma reação de neutralização, já que os produtos formados são sal e água, como podemos observar na equação geral abaixo:
YO + HX → YX + H2O
Exemplo: Reação entre o óxido de magnésio e ácido nítrico:
MgO + 2 HNO3 → Mg(NO3)2 + H2O
9ª Dica: Reação de decomposição
Reações de decomposição são aquelas em que uma substância composta forma duas ou mais substâncias, que podem ser simples ou compostas. Exemplos:
CaCO3→ CaO + CO2
2H2O → H2 + 2O2
10ª Dica: Reação de síntese
Reações de síntese são aquelas em que duas ou mais substâncias simples (podem acontecer casos em que uma substância composta participa do processo) dão origem a apenas uma substância composta. Exemplos:
H2 + Cl2 → 2HCl
2H2 + O2 → 2H2O
Ferramentas Brasil Escola
Artigos Relacionados

Últimas notícias
Outras matérias


















