Cobalto (Co)
O cobalto é um metal de transição de número atômico 27, pertencente ao grupo 9 da Tabela Periódica. O cobalto é ferromagnético e apresenta elevada resistência ao calor e à corrosão, e, por isso, a sua principal aplicação é na composição de ligas metálicas especiais, que compõem equipamentos e peças de maquinário industrial e aeroespacial. O cobalto também está presente em baterias de íon-lítio.
Esse elemento ocorre em pequena quantidade na natureza, estando normalmente associado a outros metais. A principal forma de obtenção é como subproduto da mineração do níquel e ferro.
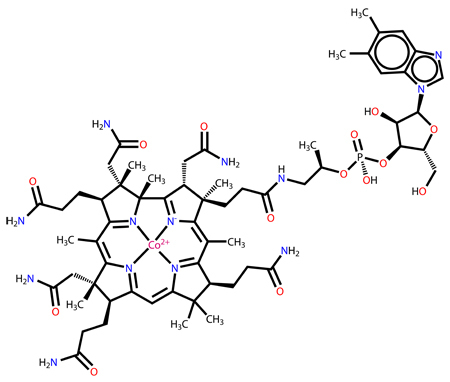
No organismo humano, o cobalto é um nutriente essencial, pois faz parte da estrutura da vitamina B12, essencial à manutenção da saúde. A deficiência dessa vitamina está associada à ocorrência de anemia perniciosa .
Leia também: Cálcio — outro elemento químico que exerce importante papel no organismo
Resumo sobre o cobalto
-
O cobalto é um metal de transição de número atômico 27 localizado no grupo 9 da Tabela Periódica.
-
O cobalto apresenta alta resistência ao calor e é ferromagnético.
-
Pela resistência ao calor e à corrosão, participa da composição de ligas metálicas especiais.
-
Cobalto é usado em baterias de íon-lítio, como pigmento, na produção de catalisadores etc.
-
A sua forma radioativa (cobalto-60) é usada na medicina e na indústria.
-
O cobalto faz parte da vitamina B12, nutriente essencial à manutenção da saúde.
Propriedades do cobalto
-
Símbolo: Co.
-
Número atômico: 27.
-
Massa atômica: 58,9 u.m.a.
-
Configuração eletrônica: [Ar] 3d7 4s2.
-
Estado físico: sólido (a 20 °C).
-
Ponto de fusão: 1495 °C.
-
Ponto de ebulição: 2927 °C.
-
Densidade: 8,9 g/cm3.
-
Eletronegatividade: 1,88 (escala de Pauling).
-
Série química: elementos de transição.
-
Localização na Tabela Periódica: grupo 9, período 4, bloco d.
-
Isótopos naturais: 59Co (100%).
Características do cobalto
Cobalto é um metal de transição de número atômico 28 pertencente ao grupo 9 da Tabela Periódica. Possui coloração cinza metálica levemente azulada e é quebradiço. Esse elemento possui propriedades próximas às do níquel (Z=28) e do ferro (Z=26).
Possui elevadas temperaturas de fusão e de ebulição, sendo um metal altamente resistente ao calor, por isso é empregado em ligas termorresistentes. O cobalto é ferromagnético, ou seja, possui capacidade de se imantar na presença de um campo magnético. Essa propriedade se conserva até 1121 °C, tornando o cobalto apto às aplicações que necessitem da propriedade magnética, mesmo em elevada temperatura.

O cobalto é lentamente dissolvido em ácidos e pode estabelecer ligações químicas com o carbono, fósforo, nitrogênio ou enxofre, desde que fornecido calor. O óxido de cobalto (CoO) pode ser formado pelo contato com o oxigênio e vapor e água, em elevadas temperaturas.
Existe apenas um isótopo natural de cobalto, o cobalto-59. A partir deste, pode ser gerado o isótopo radioativo (instável) cobalto-60 por meio de irradiação de nêutrons em um reator nuclear.
Ocorrência do cobalto
O cobalto está amplamente distribuído na crosta terrestre, no entanto está presente em quantidade muito baixa — cerca de 0,001% —, sendo classificado como o 30º elemento mais abundante. É encontrado em pequenas quantidades em minérios de níquel-ferro de origem terrestre e meteórica e em minerais como a cobaltita (CoAsS), a linneíta (Co3S4), a eritrita (Co3(AsO4)2‧8H2O) e a esmaltita (CoAs2), ocorrendo em associação a outros metais.

O metal ocorre em combinação com elementos químicos em águas naturais e em rochas no fundo de mares. Encontrado em plantas e em alguns animais, nos bovinos e ovinos o cobalto é um elemento essencial, assim como para os humanos, uma vez que esse elemento está presente na vitamina B12, fazendo parte de mecanismos de produção de glóbulos vermelhos.
Os principais países extratores de cobalto são:
Como se obtém o cobalto?
A obtenção de cobalto normalmente ocorre pela sua recuperação por meio dos procedimentos de extração de outros metais, os quais contêm cobalto como “contaminante”, como o ferro, níquel, cobre, prata, manganês, zinco e arsênio.
Para a extração, é importante que o cobalto esteja associado ao enxofre (grupos sulfeto) ou ao arsênio (grupos arsenieto), que também estão ligados ao níquel, cobre, ferro ou alumínio. Essas espécies são conduzidas pelo processo Sherritt-Gordon, iniciando pela dissolução em hidróxido de amônia, em elevada temperatura e pressão, de onde se retira o níquel. Depois disso, o cobalto dissolvido é convertido à sua forma metálica (Co0) pela ação do hidrogênio. Dependendo do mineral de origem, pode-se empregar métodos metalúrgicos ou eletrolíticos.
Saiba também: Potássio — elemento químico que atua na contração muscular
Para que serve o cobalto?
A maior parte do cobalto extraído na natureza é direcionado para a produção de ligas metálicas especiais e superligas. Uma delas são as ligas Alnico, que, formadas por diferentes proporções de alumínio, níquel, ferro e cobalto, permitem a produção de ímãs artificiais com potencial de indução magnética muito superior ao dos ímãs naturais, podendo levantar 1000 vezes o seu próprio peso. Além disso, são resistentes à oxidação e termicamente estáveis. Ímãs Alnico são usados em motores, microfones, autofalantes, sensores e em aplicações aeroespaciais e de engenharia.
As superligas são conhecidas por manter suas propriedades de estabilidade térmica e química mesmo em elevada temperatura, sendo resistentes à corrosão. São empregadas em aplicações aeroespaciais e aeronáuticas, turbinas industriais e marinhas e válvulas para automóveis e caminhões.
Veja outras aplicações mais específicas:
-
Tetraóxido de tricobalto (Co3O4): é muito usado industrialmente, participando da fabricação de cerâmicas, vidros, tintas, esmaltes e catalisadores de reações orgânicas.
-
Sulfato de cobalto (CoSO4): é muito usado na galvanoplastia e na síntese de agentes secantes.
-
Fosfato de cobalto (Co3(PO4)2‧8H2O): é conhecido como violeta cobalto e usado como pigmento na pintura de porcelanas e na fabricação de vidros.
-
Cloreto de cobalto (CoCl2‧6H2O): é um sal rosa quando hidratado e se torna azul quando desidratado, ou seja, quando perde as moléculas de água. Por isso, é usado como indicador de umidade, pela mudança de coloração de acordo com o equilíbrio químico abaixo:
\(\color{blue}{CCl_4^{2-}}+6\ H_2 O ⇌\color{magenta}{[Co(H_2 O)_6 ]^{2+}}+4\ Cl^-\)
-
Cobalto-60: é o isótopo radioativo cuja radiação gama vem sendo empregada em equipamentos de inspeção de materiais industriais para mapear a estrutura interna, revelando possíveis falhas ou objetos internos. O Co-60 também é usado na medicina, atuando no tratamento de câncer e em exames de tomografia. Na indústria, é usado em procedimentos de esterilização e como marcador radioativo, sendo útil, por exemplo, para mapear a ocorrência de uma fratura em um sistema de tubulação subterrânea.

Algumas baterias de íons lítio contêm cobalto em sua composição, sob a forma de óxido de lítio cobalto (LiCoO2) como material ativo no cátodo da célula.
Alimentos ricos em cobalto
Na dieta, a obtenção de cobalto acontece pela ingestão de alimentos contendo diretamente esse nutriente ou pelo consumo de alimentos que possuam a vitamina B12.
O cobalto está presente em:
-
feijão;
-
fígado, carnes bovinas e de peixe;
-
frutos do mar;
-
ovos;
-
manteiga;
-
nozes;
-
vegetais folhosos;
-
cereais;
-
chocolate.
A vitamina B12 é encontrada em alimentos de origem animal, como em peixes, ovos, laticínios e carnes, especialmente em órgãos, como coração, rins e fígado. Alimentos de origem vegetal não possuem a vitamina B12.

Precauções com o cobalto
Como um nutriente essencial para o organismo, o cobalto é necessário apenas em pequenas quantidades. Em excesso, o cobalto pode causar contaminação. A exposição a elevados níveis de cobalto se dá pelo contato com o metal na forma de pó ou por meio de poeiras de sais e óxidos de cobalto. Esse tipo de exposição é mais recorrente para os trabalhadores de fábricas e mineradoras.
As formas de absorção de cobalto pelo organismo são, principalmente, pela pele (dérmica) e pelas vias respiratórias. Por isso, os pulmões são um dos órgãos mais afetados, ocasionando quadros de asma e fibrose. Mais recentemente, foi verificado que a exposição a elevadas quantidades desse metal está associada ao desenvolvimento de câncer.
Para a população geral, os riscos de exposição ao cobalto se concentram na poluição ambiente, fumaça de cigarros e nos alimentos, uma vez que os resíduos industriais contendo cobalto podem alcançar regiões de produção agrícola.
Leia também: Chumbo — metal de elevada densidade e altamente tóxico
Importância do cobalto para a saúde
Nos seres humanos, o cobalto está presente sob a forma de íons, ocupando a estrutura da vitamina B12, conhecida também como cobalamina. Essa vitamina está envolvida na síntese de aminoácidos e de ácidos nucleicos e no processo de formação das hemácias (glóbulos vermelhos).
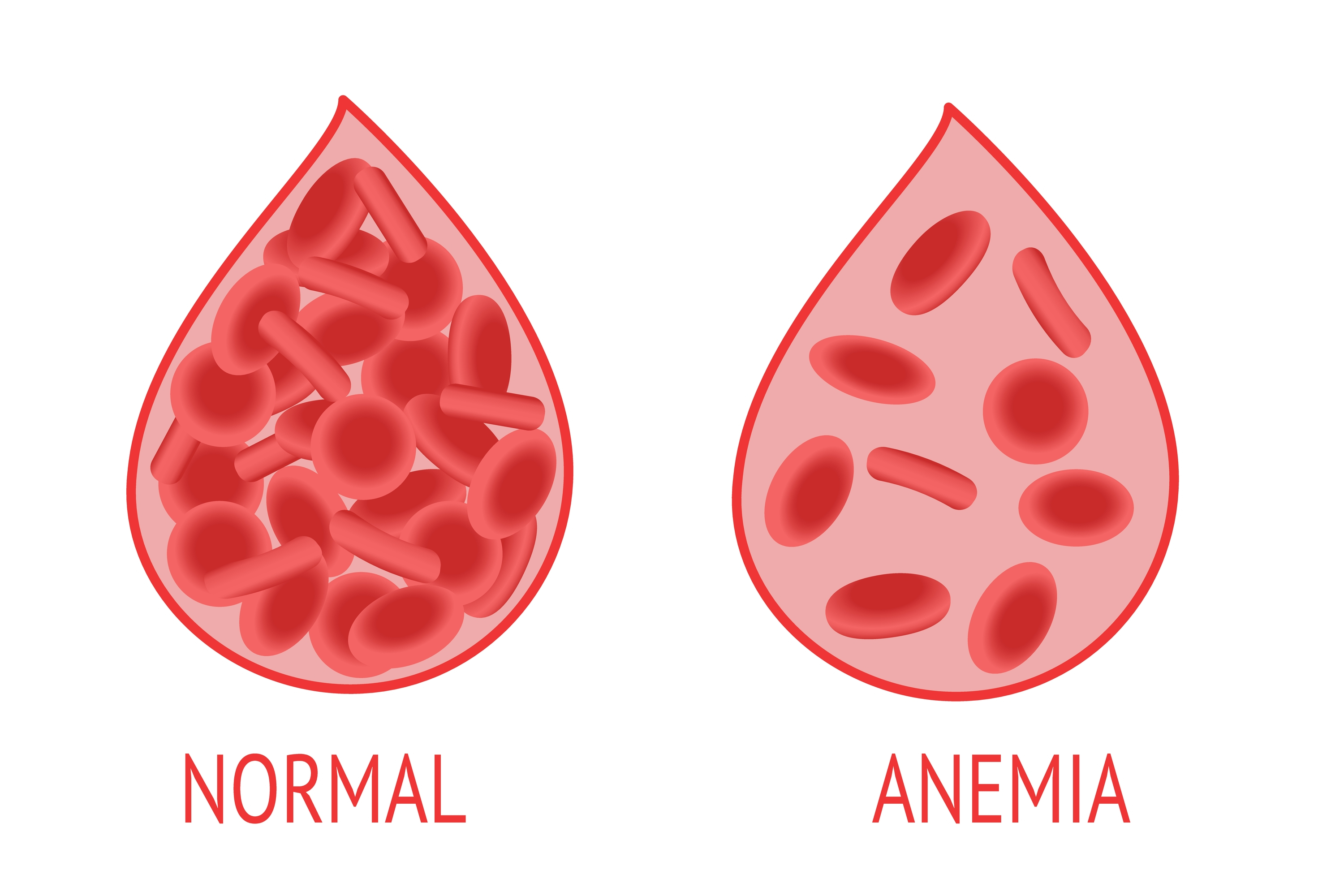
A ausência ou deficiência da vitamina B12 pode causar quadros de anemia perniciosa, que envolve sintomas como fadiga, diarreia, icterícia (pele amarela), adormecimento ou formigamento das extremidades. Além disso, lesões cerebrais também podem ser ocasionadas pela ausência dessa vitamina.
História do cobalto
Compostos de cobalto são conhecidos e usados há muito tempo, predominantemente usados como pigmento na coloração de vidro e cerâmica.
A tumba do faraó Tutancâmon (1341 a.C - 1323 a.C.) continha objetos de profunda coloração azul que posteriormente foi caracterizada como cobalto. Na China antiga, derivados de cobalto já eram usados como esmalte para cerâmicas.

Na Idade Média, sais de cobalto eram considerados valiosos minérios de cobre e prata. No entanto, não podiam ser processados e liberavam odor desagradável quando aquecidos, em razão da presença de arsênio, por isso eram considerados envenenados.
Os trabalhadores das minas daquela época, que extraíam os minérios, acreditavam que goblins ou espíritos malignos das minas ― em alemão, Kobold ― haviam comido a prata preciosa dos minérios e deixado apenas o que não tinha mais valor e os deixava doentes (o elemento arsênio possui elevada toxicidade). Em razão dessa superstição, o termo Kobold originou o nome “cobalto”.
Em 1735, o químico sueco Georg Brandt, estudando minérios azuis encontrados em usinas de cobre, conseguiu isolar o elemento cobalto de seus compostos derivados e foi capaz de descrever suas propriedades. Brandt defendeu que havia descoberto um novo elemento químico, mas não foi levado a sério na época. Apenas mais tarde, o cobalto foi oficialmente aceito como um novo elemento químico, diferente dos já conhecidos níquel e ferro.

