Elétron
O elétron é uma das partículas fundamentais formadoras do átomo e, por isso, conhecida como partícula subatômica. Os elétrons orbitam o núcleo atômico, estando localizados na eletrosfera. Eles possuem carga elétrica negativa e massa 1836 vezes menor do que a massa dos prótons.
A condutividade elétrica dos materiais é explicada pela movimentação dos elétrons em um fluxo ordenado. A condutividade térmica também se manifesta pela ação dos elétrons, assim como as ligações químicas, que são estabelecidas por meio de compartilhamento, doação ou movimentação dos elétrons entre átomos.
Leia também: Atomística — a área da Química responsável pelo estudo do átomo
Resumo sobre elétron
-
Elétrons são partículas que constituem os átomos, sendo uma das partículas subatômicas.
-
Os elétrons são encontrados na eletrosfera do átomo.
-
Elétrons possuem carga elétrica negativa de valor 1,602 · 10-19 Coulomb.
-
Os elétrons possuem massa desprezível.
-
Eles se comportam como onda e como partícula.
-
A função dos elétrons está relacionada com a estabilidade elétrica dos átomos.
-
As ligações químicas entre átomos ocorrem em razão do compartilhamento, doação ou movimentação de elétrons.
-
As propriedades de condutividade térmica e elétrica de materiais são processos associados aos elétrons.
-
A corrente elétrica nada mais é do que o movimento ordenado de elétrons.
-
Os elétrons foram descobertos por J. J. Thomson em 1897, por meio de experimentos de raios catódicos e placas metálicas carregadas positivamente.
O que é elétron?
O elétron é uma das partículas constituintes do átomo, conhecida como partícula subatômica. Elétrons possuem carga elétrica negativa e estão localizados na eletrosfera, região em torno do núcleo do átomo. Os elétrons se mantêm orbitando ao redor do núcleo atômico positivo em razão da força eletrostática de atração.
Os elétrons possuem massa muito pequena em comparação aos prótons e nêutrons, por isso, não são considerados para a estimativa da massa atômica.
Eles são os responsáveis pelo fenômeno de eletricidade e pela formação das ligações químicas que constituem as moléculas.
Propriedades do elétron
O elétron é a partícula subatômica mais leve conhecida e possui massa igual a 9,109 · 10-31 kg, sendo 1836 vezes mais leve do que um próton. Por isso, é comum dizer que a massa do elétron é desprezível. Assim, a massa de um átomo ou massa atômica é determinada apenas pela massa de prótons e nêutrons.
A carga elétrica dos elétrons tem valor igual a 1,602 · 10-19 Coulomb (C), sendo esta considerada a unidade padrão para a carga elétrica de partículas subatômicas e conhecida como carga elementar, simbolizada por e.
O próton, sendo também uma partícula subatômica, possui o mesmo valor de carga elementar do elétron, mas com sinal oposto. Assim, o elétron pode ser expresso como e-, e o próton, como e+. Nesse sentido, os átomos são estruturas eletricamente neutras com iguais quantidades de prótons (e+) e de elétrons (e-). A tabela a seguir representa as características das partículas subatômicas.
|
Partícula subatômica |
Carga (C) |
Carga relativa |
Massa (kg) |
Massa relativa |
|
Elétron |
1,602 · 10-19 |
-1 |
9,109 · 10-31 |
0 |
|
Próton |
1,602 · 10-19 |
+1 |
1,673 · 10-27 |
1 |
|
Nêutron |
0 |
0 |
1,673 · 10-27 |
1 |
Características do elétron
Os elétrons, até onde se conhece atualmente, não podem ser divididos em outras partículas menores, ou seja, não possuem subestruturas. Por isso, os elétrons são partículas elementares ou fundamentais.
Embora o elétron seja interpretado como uma partícula, ele também possui características ondulatórias. Isso significa que ele pode se comportar como uma onda ou como uma partícula, possuindo propriedades características de cada uma dessas estruturas.
Partículas são identificadas por possuírem forma e posição definida no espaço e por possuírem massa. As ondas são caracterizadas como perturbações no espaço, sem posição definida e sem massa, capazes de transportar energia e sujeitas aos fenômenos físicos de interferência, difração e reflexão.
Os elétrons e outras estruturas de escala atômica apresentam as características de partículas e de ondas, comportamento explicado pela teoria da dualidade onda-partícula, proposta por Louis de Broglie em 1923. De acordo com os estudos de De Broglie e de outros pesquisadores da época, as partículas subatômicas se comportam como “ondas de partículas”, possuindo as características de partículas e, simultaneamente, apresentando efeitos ondulatórios.

→ Posição do elétron
Na mecânica clássica, o movimento de uma partícula pode ser expresso em termos de sua posição e velocidade, de modo simultâneo e com precisão. Ao estudar partículas subatômicas, como os elétrons, a mecânica clássica não é mais adequada, e os conceitos de mecânica quântica devem ser então adotados.
De acordo com os conceitos da mecânica quântica, não é possível determinar a velocidade e a posição do elétron de modo simultâneo e mantendo a precisão das medidas. Por isso, torna-se impossível descrever uma trajetória para a movimentação dentro da eletrosfera.
Simplificadamente, isso significa que ao determinar a velocidade de um elétron com precisão, não é possível descrever a sua posição exata. E, da mesma forma, ao determinar com precisão a sua posição, perdem-se informações sobre a sua velocidade. Essa conclusão foi proposta por Werner Heisenberg e é conhecida como princípio da incerteza de Heisenberg.
Função do elétron
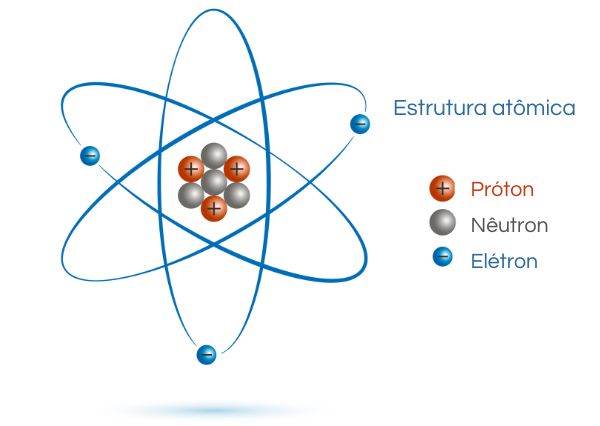
A função do elétron se relaciona com a estabilidade elétrica dos átomos. Os átomos são formados pelo núcleo e pela eletrosfera. O núcleo contém os prótons e os nêutrons, e a eletrosfera é a região onde os elétrons podem ser encontrados.
A quantidade de prótons do átomo define a natureza de um elemento químico, descrita pelo seu número atômico. Os nêutrons são partículas neutras e habitam o núcleo, minimizando os efeitos de repulsão elétrica entre os próprios prótons. Os elétrons e os prótons, possuindo cargas elétricas de mesma magnitude e de sinais opostos, se atraem mutuamente. Dessa forma, a função dos elétrons é interagir eletrostaticamente com os prótons, garantindo a estabilidade elétrica do átomo.
Elétron livre
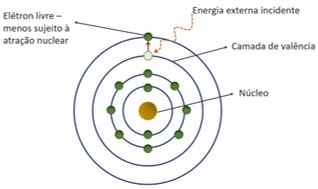
Elétrons livres são elétrons que não mais estão sob a atuação da força eletrostática de atração exercida pelo núcleo do átomo.
Na estrutura atômica, os elétrons ocupam diferentes níveis de energia na eletrosfera, sendo os níveis mais próximos ao núcleo atômico mais sujeitos à força atrativa próton-elétron.
Os elétrons mais distantes do núcleo, em um átomo, estão na camada de valência, que é a última camada da eletrosfera ocupada por elétrons. Os elétrons de valência sentem em menor intensidade a atração do núcleo.
Assim, uma pequena quantidade de energia externa, sob a forma de calor ou de luz, é suficiente para estimular esses elétrons a ocuparem outras camadas eletrônicas mais distantes do núcleo, tornando-os elétrons livres da atração nuclear. Esse processo é conhecido como salto quântico e está representado na ilustração abaixo.
Importante: A existência de elétrons livres em um material é o que permite o fenômeno de condutividade elétrica.
Aplicações do elétron
Os elétrons são as partículas responsáveis pelos fenômenos de condutividade elétrica, condutividade térmica e, inclusive, pela formação das ligações químicas. Veja a seguir.
→ Elétron e eletricidade
A condutividade elétrica é a capacidade de um material em transportar cargas elétricas e se relaciona com a quantidade de elétrons livres presentes. Como os elétrons são partículas eletricamente carregadas, quanto maior a quantidade de elétrons livres, maior será a capacidade de condução elétrica do material.
A corrente elétrica é definida como o movimento ordenado de cargas elétricas. Para que se estabeleça uma corrente elétrica, as partículas carregadas devem ser submetidas à aplicação de um campo eletromagnético, a fim de que sejam orientadas em um mesmo sentido. Assim, mesmo que um material possua elétrons livres, a corrente elétrica apenas será estabelecida quando for aplicado a ele um campo elétrico, por exemplo.
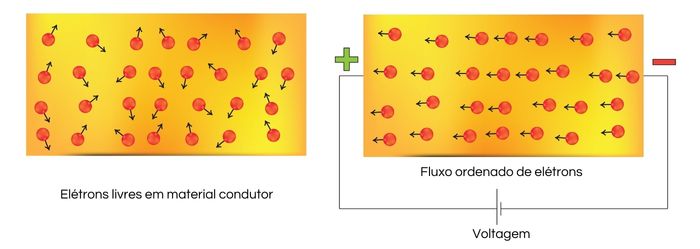
Os metais são ótimos condutores elétricos, pois possuem alta quantidade de elétrons livres. A condutividade térmica é a propriedade de um material em conduzir energia na forma de calor. A propagação de calor ao longo de um material pode acontecer por meio da vibração dos átomos e moléculas e, também, em razão da presença de elétrons livres, os quais conseguem transportar energia térmica ao longo de um material.
Sendo assim, da mesma forma que para a condutividade elétrica, quanto maior o número de elétrons livres, maior a capacidade condutora de calor de um material.
→ Elétron e ligações químicas
As substâncias químicas são formadas pela união entre diferentes elementos químicos, os quais se unem pela formação de ligações químicas. As ligações químicas podem ser de diferentes naturezas, mas todas elas envolvem os elétrons. Veja a seguir:
-
Ligações covalentes: são formadas pelo compartilhamento de elétrons entre dois elementos químicos, originado compostos covalentes.
-
Ligações iônicas: são formadas por meio de fenômenos de perda e ganho de elétrons, responsáveis por unir átomos, formando compostos iônicos.
-
Ligações metálicas: são formadas pela união de átomos e cátions metálicos que compartilham os seus elétrons livres, formando uma estrutura cristalina extensa, em que os elétrons se movimentam de forma livre em torno dos diferentes núcleos atômicos. Essa configuração de átomos origina as substâncias metálicas, justificando suas condutividades térmica e elétrica características.
Descoberta e história do elétron
A descoberta do elétron ocorreu em 1897, pelo físico britânico Joseph John Thomson. Nessa época, o átomo ainda não era muito bem entendido, e os conceitos de corrente elétrica e eletricidade ainda estavam sendo desvendados.
Thomson utilizou o aparato experimental conhecido como ampola de Crookes, formado por uma ampola de vidro com dois eletrodos contendo um gás rarefeito (baixa densidade) em seu interior. Experimentos semelhantes já vinham sendo realizados por William Crookes (o inventor da ampola) e Julius Plücker, também com a intenção de explicar a natureza da matéria dos raios catódicos.
![Joseph John Thomson com a ampola de Crookes utilizada nos experimentos de raios catódicos. [1]](https://static.mundoeducacao.uol.com.br/mundoeducacao/2022/08/thomsom-ampola-crookes.jpg)
Ao aplicar uma descarga elétrica entre o cátodo e o ânodo, um fluxo de elétrons parte da placa carregada negativamente (cátodo), sendo chamado de raios catódicos. O efeito observado é uma luminosidade verde derivada do choque entre os elétrons dos raios catódicos e o vidro da ampola.
Na condução do experimento foi verificado que os raios catódicos se propagavam em linha reta até alcançar a parede da ampola do lado oposto. No entanto, ao colocar os raios catódicos sob o efeito de um campo elétrico, pelo posicionamento de placas eletrizadas, Thomson verificou um desvio dos raios em direção à placa de carga positiva.
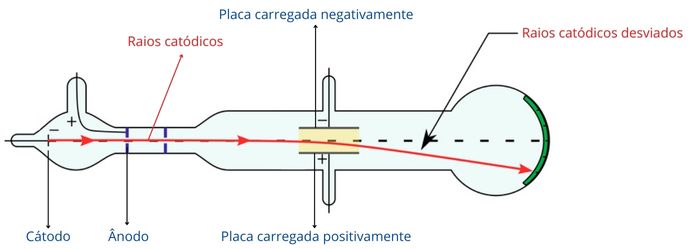
A observação da deflexão dos raios comprovou a natureza elétrica negativa deles, validando experimentalmente as hipóteses já apresentadas por outros cientistas da época.
Ao se colocar um anteparo entre o feixe e o vidro, havia a formação de sombra, indicando que o anteparo bloqueava o feixe. Essa constatação comprovou a existência de partículas com massa no próprio feixe.
Além disso, Thomson determinou que a relação entre carga e massa obtida era sempre a mesma, independentemente da substância gasosa utilizada no interior da ampola de vidro, concluindo a existência de uma partícula em comum aos elementos químicos.
Inicialmente, a partícula descoberta por Thomson foi denominada corpúsculo e, após alguns anos, ganhou o nome de elétron, sendo esse o experimento que descobriu a existência de partículas subatômicas.
Leia também: Descoberta da terceira partícula subatômica: o nêutron
Exercícios resolvidos sobre elétron
Questão 1
(Fuvest) Thomson determinou, pela primeira vez, a relação entre a massa e a carga do elétron, o que pode ser considerado como a descoberta do elétron. É reconhecida como uma contribuição de Thomson ao modelo atômico:
A) o átomo ser indivisível.
B) a existência de partículas subatômicas.
C) os elétrons ocuparem níveis discretos de energia.
D) os elétrons girarem em órbitas circulares ao redor do núcleo.
E) o átomo possuir um núcleo com carga positiva e uma eletrosfera.
Resolução:
Alternativa B
Thomson realizou experimentos com raios catódicos (feixe de elétrons) dentro de uma ampola de vidro. Ele verificou que os raios eram desviados de sua trajetória linear ao serem submetidos ao campo elétrico formado pelo posicionamento de duas placas carregadas em direção à placa de carga positiva. Esse resultado indicava a existência de partículas de carga negativa no feixe, sendo esse o experimento que descobriu a primeira das partículas subatômicas, os elétrons.
Questão 2
(Cesgranrio) A respeito dos átomos e das suas partículas elementares, tem-se que:
A) em um mesmo elemento, quando o número de prótons de um átomo é igual ao número de elétrons, obrigatoriamente o número de nêutrons no núcleo também é igual aos anteriores.
B) em uma ligação iônica, quando um átomo neutro ganha elétrons, ele se transforma em um íon com carga positiva.
C) na estrutura atômica, os prótons e os elétrons localizam-se no núcleo do átomo, e os nêutrons, na eletrosfera.
D) os elétrons possuem carga elétrica negativa, e o fluxo ordenado desses elétrons é a corrente elétrica.
E) no experimento da ampola de Crookes, comprova-se que o elétron não possui massa.
Resolução:
Alternativa D
O item A é incorreto. O átomo é uma estrutura eletricamente neutra. Para isso, o número de prótons e de elétrons precisa ser o mesmo. A função dos nêutrons é estabilizar o núcleo atômico, e a quantidade de nêutrons não é, necessariamente, igual à de prótons.
O item B é incorreto. Uma ligação iônica é formada por doação/recebimento de elétrons. Quando um átomo neutro ganha elétrons, ele se transforma em um íon com carga negativa.
O item C é incorreto. Os prótons e os nêutrons se localizam no núcleo, e os elétrons, na eletrosfera.
O item D é o item correto. Os elétrons são partículas subatômicas de carga elétrica negativa. A corrente elétrica é formada pelo fluxo ordenado dos elétrons.
O item E é incorreto. No experimento da ampola de Crookes, comprova-se a existência de partículas carregadas negativamente (elétrons) e, também, a relação massa/carga dos elétrons. Logo, o experimento comprova que os elétrons existem, são eletricamente carregados e possuem massa.
Crédito de imagem
[1] Wikimedia Commons (reprodução)

