Rádio (elemento químico)
O rádio (Ra) é um elemento químico localizado no grupo 2 da Tabela Periódica, pertencendo ao grupo dos metais alcalino-terrosos. Esse metal possui aspecto prateado e, na natureza, ocorre como impureza no minério pechblenda, uma das principais fontes de urânio.
O rádio é um elemento radioativo, sofrendo decaimento e liberando partículas alfa, beta e grande quantidade de energia. É altamente perigoso aos seres vivos, que podem desenvolver problemas nos ossos e tireoide, anemia, câncer, entre outras doenças. Estima-se que o rádio é cerca de 1 milhão de vezes mais radioativo do que o urânio.
Leia também: Radioisótopos — é o nome dado aos isótopos radioativos, como o urânio e o hidrogênio
Resumo sobre rádio
-
O rádio (Ra) é um elemento químico que possui número atômico 88.
-
Compõe a família dos metais alcalino-terrosos.
-
Possui aspecto macio e prateado.
-
É altamente radioativo, sendo perigoso aos seres vivos.
-
Ocorre em associação ao urânio no mineral pechblenda.
-
Foi isolado pela primeira vez por Marie Curie e seu marido, Pierre Currie.
-
Foi muito usado em tintas luminescentes, na medicina e em cosméticos.
-
Atualmente, alguns tipos de câncer são tratados com a radiação emitida pelo rádio, em níveis seguros para o paciente.
Propriedades do rádio
-
Símbolo: Ra
-
Número atômico: 88
-
Massa atômica: 226 u.m.a.
-
Configuração eletrônica: [Rn] 7s2
-
Estado físico: sólido (a 20 °C)
-
Ponto de fusão: 696 °C
-
Ponto de ebulição: 1500 °C
-
Densidade: 5,0 g/cm3
-
Eletronegatividade: 0,9 (escala de Pauling)
-
Série química: elementos representativos
-
Localização na Tabela Periódica: grupo 2, período 7, bloco s.
Características do rádio
O rádio é um elemento químico pertencente à família dos metais alcalino-terrosos, sendo o mais pesado deles, possui coloração prateada e é considerado um metal macio.
Apesar do aspecto brilhante, rapidamente escurece sob exposição ao ar, possivelmente em razão da formação de nitreto de rádio na superfície (Ra3N2). Assim como os demais metais alcalino-terrosos, o rádio reage com a água, formando o respectivo hidróxido Ra(OH)2.
O rádio é um elemento altamente radioativo, sendo fonte de partículas alfa, beta e radiação gama. Em razão da radioatividade, o rádio é luminescente, emitindo uma fraca luz azulada.
Veja também: Césio-137 — um isótopo radioativo que também apresenta um brilho azulado
Onde se encontra o rádio?
O rádio é um dos elementos radioativos mais raros de ser encontrados na natureza, de modo que sua principal fonte de obtenção é o mineral pechblenda, um minério rico em urânio. Dessa forma, o rádio é considerado um subproduto da mineração do urânio.

O rádio possui 34 isótopos e todos eles são radioativos. Trinta de dois isótopos de rádio possuem tempo de meia-vida curto, na escala de poucas semanas. Exceções são o rádio-226 e o rádio-228, que possuem tempos de meia-vida de 1600 anos e 5,75 anos respectivamente.
O rádio ocorre na natureza como produto de decaimento de outros elementos químicos, como urânio, tório e actínio. O rádio-226 é formado, ao longo da desintegração do urânio-238, pela emissão de partículas alfa e beta. O rádio-228 é derivado do decaimento do tório-232, que se dá pela emissão de partículas beta.
→ Ocorrência do rádio
O rádio ocorre naturalmente junto aos minérios de urânio, principalmente no mineral pechblenda, formado por óxido de urânio (U3O8). Por isso, é obtido como subproduto do refino do urânio.
As minas de urânio do Canadá e da República Democrática do Congo são conhecidas por possuírem alto teor de rádio. Grandes depósitos de pechblenda são conhecidos nos Estados Unidos, na Austrália, na Alemanha, na República Tcheca, na Inglaterra, em Ruanda, na Namíbia e na África do Sul.
Estima-se que exista na crosta terrestre cerca de 1 ppt de rádio, equivalente a 1 ng kg-1. A produção mundial de rádio é de cerca de menos de 100 g por ano.
Para que serve o rádio?
Atualmente, o elemento rádio não possui muitas aplicações em razão da alta emissão de radioatividade. No entanto, durante muito tempo, esse elemento foi amplamente empregado na medicina, em cosméticos e em tintas luminescentes, como aquelas utilizadas em relógios.
![Relógio com tinta radioativa contendo o elemento rádio. [2]](https://static.mundoeducacao.uol.com.br/mundoeducacao/2023/01/relogio-radio.jpg)
O isótopo rádio-223 ainda é usado no tratamento de alguns tipos específicos de câncer, como o câncer nos ossos.
Apesar de não possuir tanta aplicação, seus derivados são usados em determinados contextos. Por exemplo, o sulfato de rádio (RaSO4) é usado em procedimentos de calibração de instrumentos industriais de mapeamento de defeitos em peças metálicas.
Além disso, a liga metálica formada entre rádio e berílio é uma fonte de emissão de nêutrons, sendo empregada na prospecção de petróleo. Historicamente, essa liga metálica é de grande importância para a ciência, pois foi utilizada na descoberta de nêutrons, por James Chadwick, e em trabalhos de química nuclear, por Enrico Fermi. Ambos os trabalhos originaram a premiação do Prêmio Nobel de Física.
Acesse também: Frâncio — um elemento químico radioativo muito instável e de uso comercial inviável
Radioatividade do rádio
O elemento rádio é altamente radioativo, e seu processo de decaimento radioativo pode envolver sete etapas, formando como subprodutos: o radônio (Rn), o polônio (Po), o chumbo (Pb) e o bismuto (Bi), além das emissões de partículas alfa, beta e raios gama. Estima-se que o rádio seja 1 milhão de vezes mais radioativo do que o urânio.
A imagem abaixo ilustra a série de decaimento radioativo do urânio-238, na qual é gerado o rádio-226, que, por sua vez, dá continuidade à série até o chumbo-206.
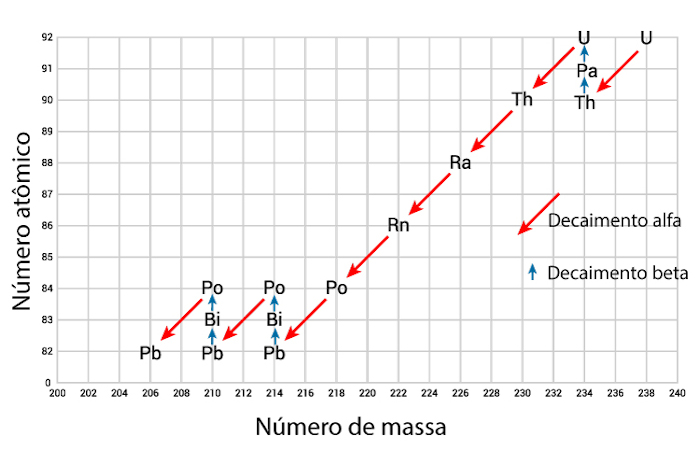
Precauções com o rádio
Por ser altamente radioativo, o elemento rádio apresenta sérios riscos aos organismos vivos. Alguns produtos do decaimento radioativo do rádio também são radioativos, como o radônio.
Em animais e humanos, o rádio é muito agressivo aos ossos, pois pode substituir o cálcio em razão da similaridade estrutural.
A exposição direta a esse elemento, pela inalação ou ingestão, pode levar ao desenvolvimento de câncer ou outros distúrbios. A radiação emitida pelo decaimento do rádio pode causar feridas na pele, desenvolvimento de doenças e morte.
No início, não se conhecia os efeitos da radioatividade. Assim, muitos trabalhadores de indústrias, principalmente mulheres (que eram a grande parte da população operária na época), desenvolveram diversas doenças associadas ao elemento radioativo, como anemias, necroses, fraqueza óssea e câncer.
![Operária confeccionando relógio com tinta contendo rádio. [3]](https://static.mundoeducacao.uol.com.br/mundoeducacao/2023/01/relogio-radio1.jpg)
História do rádio
O elemento rádio foi descoberto por Marie Curie e Pierre Curie em 1898. Com base no trabalho do casal Curie no refino de 10 toneladas de pechblenda, eles perceberam que esse mineral emitia maior radioatividade, em comparação ao urânio puro, levando-os a crer na existência de outra espécie radioativa.

Fazendo um cuidadoso tratamento dos minérios, o casal de cientistas conseguiu isolar cerca de 1 mg de rádio. O material chamava atenção, pois emitia uma fraca luz azul em ambiente escuro. A identificação do novo material foi realizada pela identificação de seu espectro atômico, que apresentava novas linhas, em relação ao conhecido espectro de urânio. A emissão luminosa do rádio se deve à emissão da radioatividade.
Mais tarde, em 1911, Marie Curie e Andre Debierne obtiveram o rádio por meio da eletrólise do sal cloreto de rádio. Para isso, fizeram a adaptação de usar um eletrodo positivo (cátodo) de mercúrio. O rádio, ao ser liberado na eletrólise, se dissolvia no mercúrio, formando uma liga. Posteriormente à eletrólise, o eletrodo era submetido à destilação, evaporando o mercúrio e isolando o rádio metálico.
Nessa época, o rádio despontou como uma alternativa energética para as demandas da sociedade. Seu uso na medicina e na área estética também foi ampliado. Pelo desconhecimento sobre os perigos da radiação, muitas pessoas desenvolveram doenças no longo prazo pela exposição ao metal, como cânceres, cegueiras e lesões cutâneas. Com o passar do tempo, novas aplicações desse elemento foram deixadas de lado em razão do alto custo de sua obtenção.
Créditos de imagem
[1] Wikimedia Commons (reprodução)
[2] Sergey Nemirovsky / Shutterstock
[3] Wikimedia Commons (reprodução)

