Solubilidade dos sais
A solubilidade dos sais é uma forma de classificação que nos mostra a capacidade que essas substâncias inorgânicas possuem de se dissolver ou não em água.
Conhecer a solubilidade dos sais é importante porque, quando eles se dissolvem em água, sofrem o fenômeno da dissociação (liberação de cátions e ânions).
![]()
Equação de dissociação do NaCl
Assim, se um sal não apresenta boa solubilidade em água, logo, não possui um alto grau de dissociação e, por isso, há uma baixa quantidade de íons.
Conceito de solubilidade
Solubilidade é a capacidade que um solvente tem de dissolver um soluto. Trata-se de uma propriedade física da matéria extremamente influenciada por variações de temperatura e pela quantidade tanto do soluto quanto do solvente.
A solubilidade do Cloreto de Sódio (NaCl), por exemplo, em água, é de 36 g a cada 100 mL de água a 20 oC. Logo, se adicionarmos, por exemplo, 72 g de cloreto de sódio em 150 mL de água, não haverá sua dissolução total. Porém, se mantivermos as quantidades de NaCl e água e modificarmos apenas a temperatura, favoreceremos a completa dissolução.
Classificação dos sais quanto à solubilidade em água
De uma forma geral, os sais inorgânicos apresentam apenas duas classificações referentes à solubilidade em água. São elas:
a) Sal solúvel
É o sal que apresenta boa capacidade de se dissolver em água. Assim, quando temos essa mistura, existe uma grande probabilidade de ela ser homogênea (apenas uma fase), pois um material estará dissolvido no outro.
b) Sal praticamente insolúvel
É um sal cuja capacidade de dissolução em água é tão pequena que, sempre que prepararmos esse tipo de mistura, ela será denominada de heterogênea, por apresentar duas fases (a água e o sal).
OBS.: Para determinar se um sal é praticamente insolúvel ou solúvel, basta conhecer os critérios de solubilidade presentes na tabela abaixo:
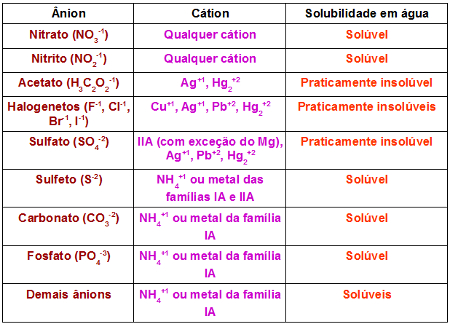
Tabela com critérios sobre a solubilidade dos sais
Exemplos de determinação da solubilidade de um sal
→ Cloreto de sódio (NaCl)
No cloreto de sódio, temos um halogeneto (Cl) ligado a um metal alcalino (família IA), por isso, é um sal solúvel.
→ Nitrato de potássio (KNO3)
No nitrato de potássio, temos o ânion nitrato (NO3-) associado ao cátion potássio (K+). É classificado como um sal solúvel porque todo sal que apresenta nitrato é solúvel.
→ Sulfato de alumínio [Al2(SO4)3]
O sulfato de alumínio é um sal solúvel porque não apresenta os cátions Mg+2, Ca+2, Sr+2, Ag+1, Hg2+2 e Pb+2.

