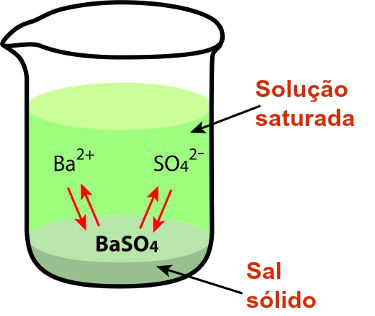
Constante do produto de solubilidade
O cálculo do produto de solubilidade é utilizado para determinar se uma solução é saturada, insaturada ou saturada com precipitado, bem como se um determinado eletrólito é muito ou pouco solúvel em um determinado solvente.
Para realizar o cálculo do produto de solubilidade, são necessários alguns fatores importantes, a saber:
a) Equilíbrio de dissolução
Quando um eletrólito (soluto) qualquer é misturado com a água, forma-se um equilíbrio químico entre o eletrólito (YX(s)) e os íons que ele libera na solução. Ao se dissolver no solvente, o eletrólito sofre dissociação e libera um cátion (Y+) e um ânion (X-).
.jpg)
Equação de dissociação de um eletrólito qualquer
OBS.: a e b são os coeficientes relacionados com a quantidade de átomos de cada íon no eletrólito.
Assim, devemos conhecer quais são os íons liberados pelo eletrólito durante a dissociação.
b) Os valores das concentrações dos íons na solução
Para o cálculo do produto de solubilidade, devemos conhecer a concentração molar (molaridade, mol/L) de cada um dos íons presentes na solução a partir da dissociação:
-
[Y+] = concentração molar do cátion
-
[X-] = concentração molar do ânion
c) Montar a expressão do Kps
.jpg)
Equação de dissociação de um eletrólito qualquer
Para construir a expressão para o cálculo do produto de solubilidade, basta multiplicar as concentrações de cada um dos íons, que devem estar elevados aos seus coeficientes da equação:
Kps = [Y+]a.[X-]b
d) Interpretações a partir do cálculo do Kps
-
Quanto menor é o valor do Kps, menos solúvel é o eletrólito;
-
Se Kps = [Y+]a.[X-]b, a solução é saturada;
-
Se Kps < [Y+]a.[X-]b, a solução é insaturada;
-
Kps > [Y+]a.[X-]b, a solução é saturada com precipitado.
Veja dois exemplos:
Exemplo: (PUC-SP) A solubilidade do PbSO4 (303,2 g/mol) em água é igual a 0,045 grama por litro a 25oC. Qual é o valor do Kps do sal nessa temperatura?
a) 4,56.107
b) 4,5.10-2
c) 2,02.10-3
d) 1,48.10-4
e) 2,19.10-8
1o Passo: Montar a equação de dissociação do sal.
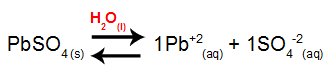
2o Passo: Determinar a expressão do Kps do eletrólito.
O Kps do sulfato de prata deve ter a concentração da prata elevada a 1 (na equação, temos o coeficiente 1 no chumbo) multiplicando a concentração do ânion sulfato (SO4-2) elevada a 1 (na equação, temos o coeficiente 1 no sulfato):
Kps = [Pb+2]1.[SO4-2]1
3o Passo: Determinar a concentração em mol/L do eletrólito a partir da concentração em g/L.
Para converter a concentração em g/L para a concentração em mol/L, basta dividir a concentração em g/L pela massa molar:
M = C
M1
M = 0,045
303,2
M = 1,48.10-4 mol/L (aproximadamente)
4o Passo: Determinar a concentração em mol/L de cada um dos íons provenientes do sal.
Para isso, basta multiplicar o coeficiente do íon pela concentração encontrada no item anterior.
-
Para o Pb+2
[Pb+2] = 1.1,48.10-4 mol/L
[Pb+2] = 1,48.10-4 mol/L
-
Para o SO4-2
[SO4-2] = 1.1,48.10-4 mol/L
[SO4-2] = 1,48.10-4 mol/L
5o Passo: Calcular o Kps.
Kps = [Pb+2]1.[SO4-2]1
Kps = 1,48.10-4 .1,48.10-4
Kps = 2,19.10-8 mol/L
Exemplo: (Fuvest) A determinada temperatura de toC, a solubilidade do sulfato de prata, Ag2SO4 (312 g/mol), em água é 2.10-2 mol/L. O produto de solubilidade desse sal, na mesma temperatura, é:
a) 4,0.10-4
b) 8,0.10-4
c) 6,4.10-5
d) 3,2.10-5
e) 8,0.10-6
1o Passo: Montar a equação de dissociação do sal.
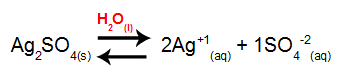
2o Passo: Determinar a expressão do Kps do eletrólito.
O Kps do sulfato de prata deve ter a concentração do cátion prata elevada ao quadrado (na equação, temos o coeficiente 2 na prata) multiplicando a concentração do ânion sulfato (SO4-2) elevada a 1 (na equação, temos o coeficiente 1 no sulfato):
Kps = [Ag+1]2.[SO4-2]1
3o Passo: Determinar a concentração de cada um dos íons provenientes do sal.
Para determinar a concentração em mol/L dos íons, basta multiplicar o coeficiente do íon pela solubilidade (concentração) do sal fornecida no enunciado (2.10-2 mol/L).
-
Para o Ag+
[Ag+] = 2. 2.10-2 mol/L
[Ag+] = 4.10-2 mol/L
-
Para o SO4-2
[SO4-2] = 1. 2.10-2 mol/L
[SO4-2] = 2.10-2 mol/L
4o Passo: Calcular o Kps.
Kps = [Ag+1]2.[SO4-2]1
Kps = (4.10-2)2.(2.10-2)1
Kps = 16.10-4.2.10-2
Kps = 32.10-6 mol/L
ou
Kps = 3,2.10-5 mol/L