Reações de adição
Reações de adição são aquelas em que adicionamos átomos ou agregados atômicos a uma molécula insaturada do tipo alceno, alcino, alcadieno, aromático ou ciclano, que perde ou diminui suas insaturações. Estudaremos neste artigo as reações de adição do tipo hidrogenação, halogenação, hidro-halogenação e hidratação. Uma utilização comercial muito popular para uma reação de adição é a fabricação da margarina, que nada mais é do que a hidrogenação (um tipo de reação de adição) de uma gordura vegetal insaturada.
Leia também: Reações de eliminação – reações orgânicas em que há a desvinculação de parte de uma molécula
Como ocorrem as reações de adição?
Para se adicionar átomos ou agregados a uma molécula, o pré-requisito é que essa molécula tenha pelo menos uma insaturação, ou seja, uma ligação π (pi). Essa ligação será rompida para que ali entrem os compostos a serem adicionados, ou seja, para cada quebra de uma ligação π, acontece a formação de duas ligações do tipo sigma (σ).

Tipos de reações de adição
-
Adição de hidrogênio (hidrogenação ou reação de Sabatier-Sederens)
A hidrogenação é a adição de hidrogênios a uma molécula com insaturação a partir da quebra de uma ligação pi e. Para que essa reação aconteça, são necessárias condições ideais de temperatura e pressão e também um catalisador, que pode ser o níquel (Ni) ou a platina (Pt). Veja o exemplo a seguir da hidrogenação de um alceno.
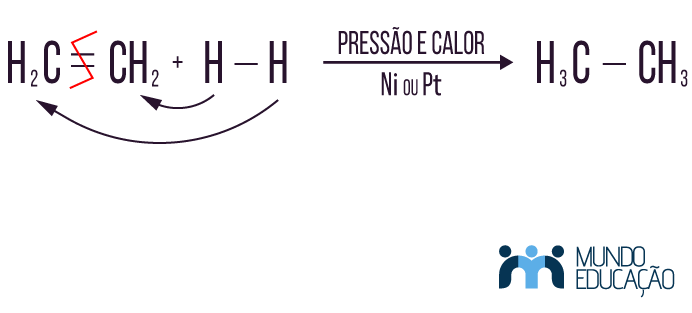
Perceba que o composto, após passar pela reação de adição, perde a insaturação da molécula. Tem-se como produto uma molécula da função alcano.
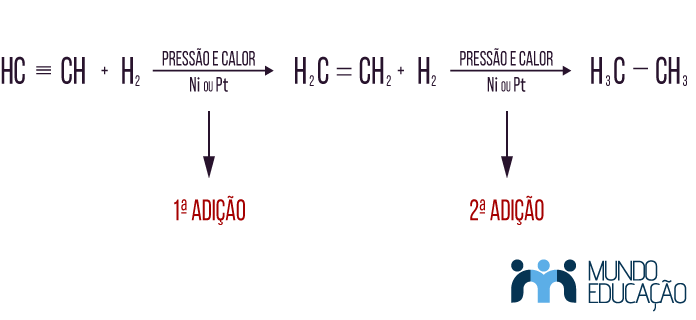
Para reações de adição de hidrogênio em moléculas da função alcino ou outra com mais de uma insaturação, o processo é o mesmo. O que difere é que há duas etapas, duas ligações pi são rompidas, e o produto final é um número maior de hidrogênios. Para que aconteça a hidrogenação completa, ou seja, para que não haja mais insaturações no composto, é necessário um catalisador forte, pois, no caso da hidrogenação, a segunda etapa é um processo lento. Se o catalisador não for forte, essa etapa não acontecerá.
Exemplo:
A hidrogenação é a reação utilizada para transformar gorduras insaturadas em gorduras saturadas. Um alimento do nosso cotidiano proveniente dessa reação é a margarina.
A imagem a seguir é a hidrogenação feita em escala industrial. Em um tanque, é colocado óleo vegetal insaturado, que vai ser girado por um impulsor de metal, geralmente feito de platina ou níquel. Nesse tanque há um sistema que leva o gás hidrogênio para ser dispersado por um cano submerso ao óleo. Todo o sistema é mantido em condições ideais de temperatura e pressão.

Para conhecer mais detalhes acerca dessa reação de adição, acesse: reação de hidrogenação.
-
Adição de halogênio (halogenação)
Na reação de halogenação, assim como na hidrogenação, acontece a quebra de uma insaturação, isto é, há o rompimento de uma ligação π para que haja a adição de átomos novos à molécula. Nesse caso, são adicionados halogênios, que são átomos da família 7A (I, Br, Cl, F). Todavia, para a reação de adição, não vamos considerar o flúor (F), que, por ser um átomo muito reativo, pode destruir a molécula orgânica original. Para reações de adição de halogênio, não é necessário o uso de catalisadores, pois se trata de uma reação espontânea.
Exemplo:
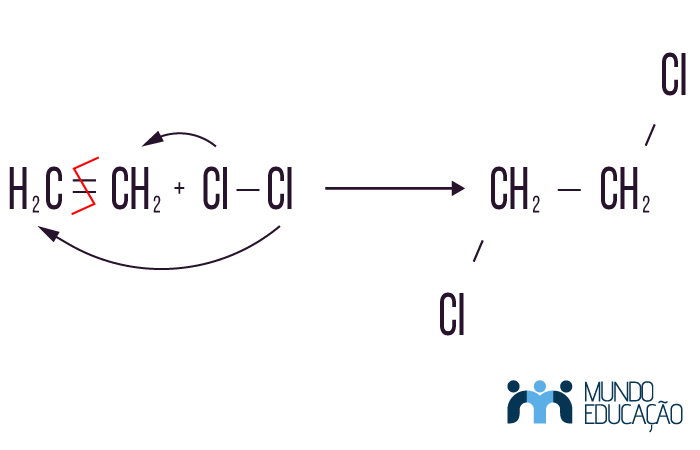
No exemplo, os reagentes são uma molécula da função alceno e o cloro no estado gasoso. Como produto, temos um composto da função haleto.
A halogenação de alcinos ou moléculas orgânicas com mais de uma insaturação segue o mesmo processo. Como se trata de uma reação espontânea, enquanto houver reagentes e insaturações na molécula, a reação continuará acontecendo. Caso queira entender melhor esse processo, leia: reação orgânica de adição por halogenação.
-
Adição de haletos de hidrogênio (hidro-halogenação)
A reação de adição de haletos de hidrogênio é a inserção de um hidrogênio e um halogênio em uma molécula orgânica insaturada, que perde a insaturação como nos demais casos de reação de adição. Vale ressaltar que, para reações com halogênios, não se usa o flúor, que é muito reativo, então os possíveis reagentes para esse tipo de adição são, em ordem de reatividade: HI, HBr, HCl.
Exemplo:
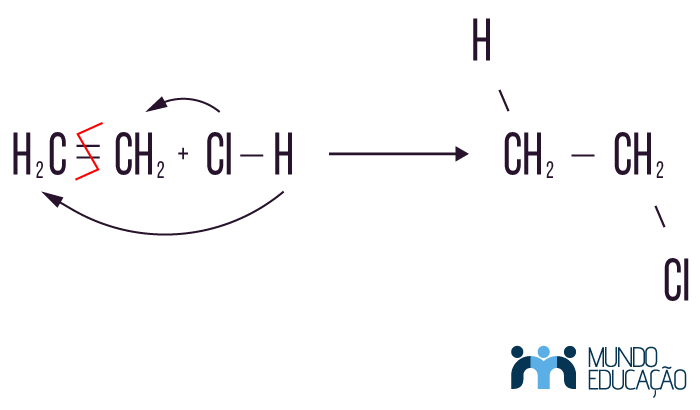
Veja que, nesse tipo de adição, nossos reagentes são um hidro-halogênio e uma molécula da função alceno. Como produto obtivemos uma molécula do tipo haleto orgânico, mais especificamente um cloreto de etila.
-
Adição de água (hidratação)
Inicialmente temos como reagentes uma molécula da função alceno e uma molécula de água. Como produto da reação, obtivemos uma molécula do tipo álcool.
A adição de água ou a hidratação de uma molécula orgânica ocorre com a quebra de uma insaturação e na presença de ácido; assim, a molécula de água é dividida em duas partes: hidroxila e hidrogênio. Ambos se direcionam para carbonos vizinhos, que antes faziam parte da dupla ou tripla ligação. Observe o exemplo:
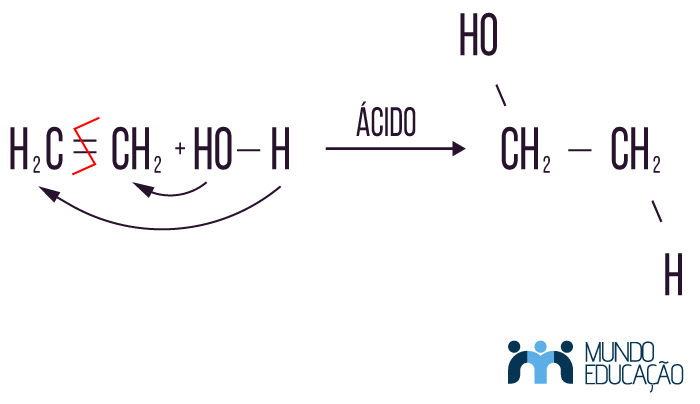
Regra de Markovnikov
Em reações de hidro-halogenação e de hidratação, em que a cadeia carbônica admite mais de um carbono possível para ser adicionado o hidrogênio, devemos levar em conta que haverá, como resultado da reação, dois produtos diferentes. No entanto, um desses isômeros (compostos diferentes com mesma fórmula molecular) possui mais probabilidade de acontecer. O que diz a regra de Markovnikov é que o hidrogênio tende a se ligar ao carbono mais hidrogenado, ou seja, o carbono que tem mais hidrogênios ligados diretamente a ele.
-
Exemplo:
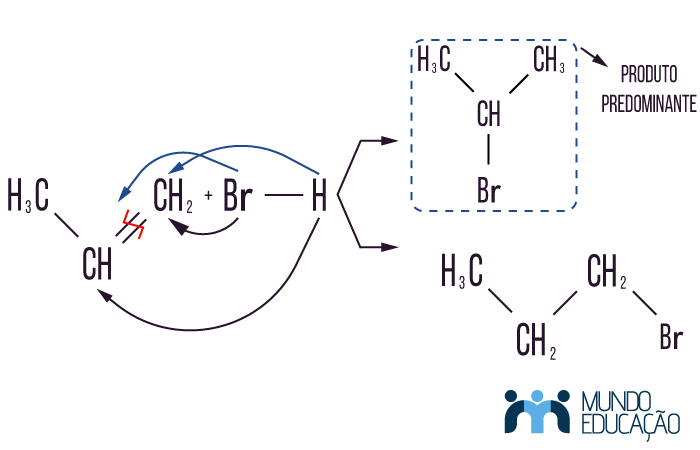
Para saber mais detalhes dessa lei química, veja o texto: explicação teórica da regra de Markovnikov.
Exercícios resolvidos
Questão 1 - (Fuvest) Dois hidrocarbonetos insaturados, que são isômeros, foram submetidos, separadamente, à hidrogenação catalítica. Cada um deles reagiu com H2 na proporção, em mol, de 1:1, obtendo-se em cada caso um hidrocarboneto de fórmula C4H10. Os hidrocarbonetos que foram hidrogenados poderiam ser:
A) 1-butino e 1-buteno.
B) 1,3-butadieno e ciclobutano.
C) 2-buteno e 2-metilpropeno.
D) 2-butino e 1-buteno
E) 2-buteno e 2-metilpropano.
Resolução
Alternativa C. Para resolver essa questão, vamos observar a reação de traz para frente. Se temos um produto cuja fórmula molecular é C4H10 e ele foi submetido a uma hidrogenação, ou seja, adição de H2, podemos deduzir que a fórmula molecular do reagente é C4H8, com dois hidrogênios a menos antes da adição. Agora é só montar as possíveis estruturas para C4H8, que serão:

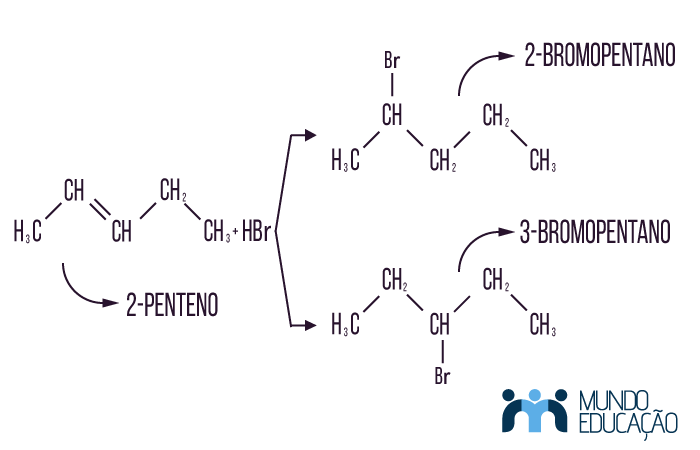
Questão 2 - (PUC) Reagindo 2-penteno com Hbr, obteremos:
A) somente 2-bromopentano.
B) somente 3-bromopentano.
C) uma mistura de 2-bromopentano e 3-bromopentano.
D) pentano não reage com HBr.
E) 2,3-dibromopentano.
Resolução
Alternativa C. Essa reação é uma hidro-halogenação em que o bBromo pode ligar-se tanto ao carbono 2 quanto ao 3. A regra de Markovnikov não se aplica a esse caso, pois os dois carbonos em questão estão igualmente hidrogenados; portanto, o resultado da reação é uma mistura aleatória de 2-bromopentano e 3-bromopentano.