Leis de Gay-Lussac
Joseph Louis Gay-Lussac foi um físico-químico francês que, por volta do ano de 1808, começou a realizar trabalhos de pesquisa sobre a atmosfera superior por meio do uso de balões para estudar as propriedades e o comportamento dos gases.
Além do seu trabalho com os gases, Gay-Lussac também realizou experimentos sobre a eletrólise da água, com os quais acreditava ter descoberto a composição da água. Com todos esses trabalhos, esse cientista pôde propor leis, as quais levam seu nome, ou seja, leis de Gay-Lussac.
→ 1ª Lei de Gay-Lussac (Lei das Proporções Volumétricas Constantes)
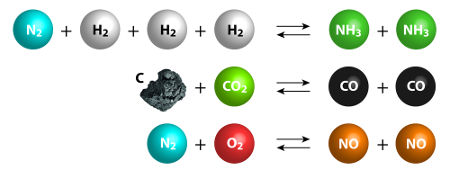
A primeira lei de Gay-Lussac está relacionada com o estudo do volume dos participantes gasosos de uma reação química. Nesse estudo, o cientista realizava reações químicas nas quais tanto os reagentes quanto os produtos eram gases.
Além de trabalhar apenas com gases nas reações, Gay-Lussac realizava-as sempre mantendo a pressão e temperatura constantes. Assim, ele enunciou uma lei que foi denominada de Lei das proporções volumétricas constantes, a saber:
‘’Os volumes de substâncias gasosas que reagem e são produzidas em uma reação química, realizada com temperatura e pressão constantes, obedecem entre si a uma relação de números inteiros.’’
Veja a reação de síntese da água (H2O) a partir do gás hidrogênio (H2) e do gás oxigênio (O2):
2H2 + 1O2 → 2H2O
Na equação, temos que dois volumes de hidrogênio reagem com 1 volume de oxigênio, formando 2 volumes de água. Esses volumes são os próprios coeficientes da equação. Assim, a quantidade de gás oxigênio utilizada deve ser sempre a metade da quantidade de gás hidrogênio, ou seja, se utilizarmos 10 litros de gás hidrogênio, utilizaremos cinco litros de gás oxigênio, formando necessariamente 10 litros de água.
→ 2ª Lei de Gay-Lussac (Lei das Transformações Isocóricas)
A segunda lei de Gay-Lussac, que é denominada de transformação isocórica ou transformação isovolumétrica, está relacionada com o comportamento dos gases quando submetidos a um volume constante. A elaboração dessa lei contou com a participação do cientista francês Jacques Alexandre Cesar Charles.
De acordo com Lussac, quando um gás é colocado em um recipiente a um volume constante, verifica-se que, se uma pressão for exercida sobre esse gás, ocorrerá um aumento proporcional da temperatura absoluta desse gás.
De forma geral, segundo a lei de Gay-Lussac, pressão e temperatura de um gás sempre serão diretamente proporcionais, desde que o volume seja constante. Assim, aumentando a pressão, aumenta-se a temperatura; diminuindo a pressão, diminui-se a temperatura.
Essa lei de Gay-Lussac pode ser empregada pela relação matemática a seguir:
P = K
T
A partir dessa questão, podemos afirmar que a pressão de um gás dividida pela temperatura do gás será sempre igual a uma constante. Por isso, podemos determinar a pressão inicial (Pi) ou final (Pf) ou temperatura inicial (Ti) e final (Tf) a que um gás está sendo submetido a partir desta relação matemática:
Pi = Pf
Ti Tf
Exemplo de aplicação: (Med. Pouso Alegre-MG) Ao sair de viagem, o motorista calibrou os pneus do seu veículo colocando no seu interior 2 atm de pressão, em um dia quente, a 27°C. Ao chegar ao destino, mediu novamente a pressão dos pneus e encontrou 2,2 atm. Considerando-se desprezível a variação do volume, a temperatura do pneu, ao final da viagem, era de quantos graus Celsius?
Resolução:
-
Pressão inicial → 2 atm
-
Temperatura inicial → 27 oC + 273 = 300 K
-
Pressão final → 2,2 atm
-
Temperatura final → ?
Substituindo na expressão:
Pi = Pf
Ti Tf
2 = 2,2
300 Tf
2.Tf = 300.2,2
2.Tf = 660
Tf = 660
2
Tf → 330K – 273 = 57oC
OBS.: Como na transformação isovolumétrica a pressão é diretamente proporcional à temperatura, o gráfico que ilustra essa transformação apresenta uma reta, como no modelo a seguir:
Gráfico de uma transformação isocórica
→ 3ª Lei de Gay-Lussac (Lei das transformações isobáricas)
A terceira lei de Gay-Lussac, a qual também contou com a participação do cientista francês Jacques Alexandre Cesar Charles, é denominada de transformação isobárica. Ela está relacionada com o comportamento dos gases quando submetidos a uma pressão constante.
De acordo com Lussac, quando um gás é colocado em um recipiente a uma pressão constante, verifica-se que, se o volume for modificado, ocorrerá um aumento proporcional da temperatura absoluta desse gás.
De forma geral, segundo a lei de Gay-Lussac, volume e temperatura de um gás sempre serão diretamente proporcionais, desde que a pressão seja constante. Assim, aumentando o volume, aumenta-se a temperatura; diminuindo o volume, diminui-se a temperatura.
Essa lei de Gay-Lussac pode ser empregada pela relação matemática abaixo:
K = V
T
A partir dessa relação, podemos afirmar que o volume de um gás dividido pela temperatura do gás será sempre igual a uma constante. Por isso, podemos determinar o volume inicial (Vi) ou final (Vf) ou temperatura inicial (Ti) e final (Tf) a que um gás está sendo submetido a partir desta relação matemática:
Vi = Vf
Ti Tf
OBS.: O gráfico da transformação isobárica é semelhante ao gráfico da transformação isocórica, demonstrado no item 2, já que ambas as transformações apresentam variáveis diretamente proporcionais.



