Hidrogênio
O Hidrogênio, em latim Hidrogenyum, é um elemento químico que foi descoberto no ano de 1766 pelo físico-químico francês Henry Cavendish. Trata-se de um elemento com características únicas, ou seja, não se assemelha a nenhum outro elemento químico conhecido pelo ser humano, não sendo nem metal nem ametal.
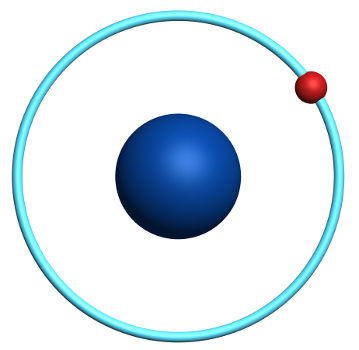
O Hidrogênio apresenta massa atômica igual a 1 g/mol e número atômico igual a 1, número atômico esse que resulta da seguinte distribuição eletrônica:
1s1
Ele está posicionado no primeiro período da família IA (metais alcalinos) da Tabela Periódica, mas não faz parte dela, já que não apresenta características físicas e químicas semelhantes aos elementos dessa família. Foi incluído nela por se assemelhar em relação ao subnível mais externo (s1).
De uma forma geral, o Hidrogênio é o elemento mais abundante de todo o universo (sendo o combustível de milhares de estrelas, como o sol) e o quarto elemento mais abundante no planeta Terra.
Formas em que o hidrogênio é encontrado na natureza
-
Faz parte da composição química de diversas substâncias orgânicas (proteínas, carboidratos, vitaminas, lipídios etc.) e inorgânicas (ácidos, bases, sais e hidretos);
-
No ar atmosférico em sua forma molecular, a partir de ligação covalente entre dois átomos (H2).
Características do Hidrogênio atômico
-
Possui três isótopos (átomos de mesmo número atômico e diferentes números de massa), sendo eles o prótio (1H1), deutério (1H2) e o trítio (1H3);
-
Apresenta apenas um nível eletrônico;
-
Possui um único próton em seu núcleo;
-
Possui apenas um elétron em seu nível eletrônico;
-
O número de nêutrons depende do isótopo: prótio (0 nêutrons), deutério (1 nêutron) e trítio (2 nêutrons);
-
Possui um dos menores raios atômicos da Tabela Periódica;
-
Possui maior eletronegatividade que qualquer elemento metálico;
-
Possui maior potencial de ionização que qualquer elemento metálico;
-
É um átomo capaz de se transformar em um cátion (H+) ou um ânion(H-).
Características do Hidrogênio molecular
-
Em temperatura ambiente, é sempre encontrado no estado gasoso;
-
É um gás inflamável;
-
Seu ponto de fusão é de -259,2oC;
-
Seu ponto de ebulição é de -252,9oC;
-
Possui massa molar igual a 2 g/mol, sendo o gás mais leve;
-
Apresenta uma ligação covalente sigma, tipo s-s, entre os dois átomos de hidrogênio envolvidos;
-
Entre os átomos, existe compartilhamento de dois elétrons;
-
Possui geometria molecular do tipo linear;
-
Suas moléculas são apolares;
-
Suas moléculas interagem por meio de forças dipolo induzido.
Formas de obtenção do Hidrogênio molecular (H2)
a) Método físico
O hidrogênio molecular pode ser obtido a partir do ar atmosférico, já que é um dos gases presentes nessa mistura. Para tal, é necessário submeter o ar atmosférico ao método de liquefação fracionada e, em seguida, à destilação fracionada.
b) Método químico
O hidrogênio molecular pode ser obtido por meio de reações químicas específicas, como:
-
Simples troca: reação na qual um metal não nobre (Me) desloca o hidrogênio presente em um ácido inorgânico (HX), formando um sal qualquer (MeX) e o hidrogênio molecular (H2).
Me + HX → MeX + H2
-
Hidratação do carvão coque (subproduto do carvão mineral): nessa reação o carbono (C) do carvão interage com o oxigênio da água (H2O), formando monóxido de carbono e o gás hidrogênio
C + H2O → CO + H2
-
Eletrólise da água: quando a água é submetida ao processo da eletrólise, ocorre a formação dos gases oxigênio e hidrogênio.
H2O(l) → H2(g) + O2(g)
Principais utilizações do hidrogênio
-
Reagente de diversas reações orgânicas;
-
Combustível de foguetes e veículos automotivos;
-
Reagente em reações de formação de ácidos e hidretos inorgânicos;
-
Maçaricos específicos para o corte de metais.



