Eletroquímica no Enem
Afinal, como é cobrada a eletroquímica no Enem? A eletroquímica é um tema recorrente do Enem, e seus objetos de conhecimento estão dispostos na Matriz de Referência do exame. Os conceitos abordados de eletroquímica estão dispostos no tópico “Transformação química e energia”, com destaque para reações redox, pilha, potenciais padrão de redução e eletrólise.
A eletroquímica no Enem também aborda temas contextualizados, trazendo discussões acerca da utilização de baterias, produção de metais, além de corrosão e práticas anticorrosivas.
A eletroquímica é uma área da Química com amplo interesse e demanda da sociedade atual, principalmente no que diz respeito ao desenvolvimento de baterias mais eficientes, leves e com maior autonomia.
Leia também: O que é o NOX?
Resumo sobre eletroquímica no Enem
- A eletroquímica é um tema recorrente no Enem.
- Alguns temas cobrados são a compreensão de reações redox, potenciais padrão de redução, pilha e eletrólise.
- Também é possível ver temas contextualizados sobre a mineração, metalurgia e produção de substâncias, como o hidróxido de sódio.
- A eletroquímica é uma área da Química com ampla utilização na sociedade moderna, permitindo o desenvolvimento de baterias de grande autonomia e eficiência.
Videoaula sobre eletroquímica no Enem
O que mais cai de eletroquímica no Enem?
Os conceitos de eletroquímica abordados no Enem estão dispostos no documento oficial do Inep, a Matriz de Referência, mais especificamente no anexo, que dispõe dos objetos de conhecimentos. Dentro desse campo, a eletroquímica é exposta em alguns tópicos, dispostos a seguir.
→ Transformação química e energia
Dentro desse tópico, a eletroquímica está explicitada por meio dos seguintes conceitos:
- transformações químicas e energia elétrica;
- reação de oxirredução;
- potenciais padrão de redução;
- pilha;
- eletrólise;
- leis de Faraday.
Dos conceitos apresentados, percebe-se uma maior ocorrência de questões que associam os potenciais padrão de redução com as pilhas.
→ Relações da Química com as tecnologias, a sociedade e o meio ambiente
Esse tópico versa mais sobre contextualizações dos conceitos de Química, ou seja, a aplicação de conceitos básicos de Química sob a ótica da indústria, saúde, agricultura, dos alimentos, entre outros. Aqui, é possível destacar alguns temas, como:
- obtenção e utilização do cloro e hidróxido de sódio;
- mineração;
- metalurgia.
Isso porque, por exemplo, a obtenção de cloro e hidróxido de sódio pode ser feita mediante eletrólise aquosa do cloreto de sódio. O tópico de mineração e metalurgia também é importante, pois muitos metais são obtidos por processos eletroquímicos.
Veja também: Qual é a diferença entre pilhas e baterias?
Conceitos de eletroquímica
Alguns conceitos-chave de eletroquímica são essenciais para realizar a prova. Nesse sentido, é importante ter maior assimilação e compreensão dos seguintes conceitos:
- Reação de oxirredução (ou redox): reação química que envolve transferência de elétrons. Para tal, uma espécie se oxida (aumenta seu número de oxidação ao perder elétrons), enquanto outra espécie se reduz (diminui seu número de oxidação ao ganhar elétrons).
- Células eletroquímicas: são dispositivos eletroquímicos que viabilizam a ocorrência das reações redox, sem o contato necessário entre reagentes e produtos.
- Processo eletroquímico espontâneo: a reação redox ocorre de maneira espontânea, transformando a energia química da reação em energia elétrica. Células eletroquímicas que produzem reações espontâneas são chamadas de células galvânicas ou voltaicas.
- Processo eletroquímico não espontâneo: a reação redox precisa de energia para ocorrer, ou seja, a energia elétrica é utilizada para desencadear a reação química. Células eletroquímicas que têm reações de oxirredução não espontâneas são chamadas de células eletrolíticas.
- Pilha: exemplo de uma célula galvânica ou voltaica, ou seja, um dispositivo utilizado para produzir energia elétrica via reações redox.
- Eletrólito: meio que conduz corrente elétrica por via iônica, ou uma substância que, ao se dissolver, forma uma solução condutora de eletricidade.
- Solução eletrolítica: uma solução de eletrólitos.
- Eletrodo: condutor metálico que entra em contato com uma solução eletrolítica em uma célula eletroquímica.
- Ânodo: eletrodo da célula eletroquímica em que ocorre a reação de oxidação.
- Cátodo: eletrodo da célula eletroquímica em que ocorre a reação de redução.
- Equação global: junção da reação que ocorre no ânodo com a reação que ocorre no cátodo.
- Potencial padrão (E°): é o potencial de um eletrodo, medido em condições padrão (a concentração do soluto é de 1 mol.L−1), em relação ao eletrodo padrão de hidrogênio, convencionado com valor zero. Assim, a diferença de potencial dessa célula eletroquímica é utilizada para dimensionar os potenciais de substâncias individuais, já que não é possível realizar uma reação de oxidação isolada de uma reação de redução.
- Potencial padrão de redução (E°R): é o potencial padrão de uma semirreação de redução de uma substância específica. Quanto maior o potencial padrão de redução da substância, maior a sua tendência de se reduzir em um processo eletroquímico.
- Potencial padrão de oxidação (E°O): é o potencial padrão de uma semirreação de oxidação de uma substância específica. Quanto maior o potencial padrão de oxidação da substância, maior a sua tendência a se oxidar em um processo químico. O potencial de oxidação é o inverso do potencial de redução (E°O = −E°R); por isso, quanto maior o potencial de oxidação, menor a tendência a se reduzir.
- Diferença de potencial (d.d.p.): comumente chamada de voltagem, é uma medida do trabalho para deslocar uma carga elétrica de um ponto a outro. É medida em volts, V. Se a d.d.p. for positiva, a reação redox é espontânea, do contrário, é não espontânea. Pode ser calculada das seguintes formas:
d.d.p. = E°R (maior) – E°R (menor)
ou
d.d.p. = E°R + E°O
- Agente redutor: substância que causa a redução de outro elemento, oxidando-se como consequência.
- Agente oxidante: substância que causa a oxidação de outro elemento, reduzindo-se como consequência.
- Corrosão: processo espontâneo de deterioração de metais e ligas, causado por interações químicas, bioquímicas e eletroquímicas entre os metais e o meio ambiente. Metais que sofrem corrosão são convertidos em compostos termodinamicamente mais estáveis, como óxidos, hidróxidos, sais ou carbonatos, assim oxidando-se durante o processo. Saiba mais sobre esse processo clicando aqui.
- Metal de sacrifício: também conhecido como proteção catódica, é a utilização de um metal de menor potencial de redução em relação a um metal de interesse. Dessa forma, o metal de sacrifício acaba se oxidando/corroendo no lugar do metal de interesse.
- Eletrodeposição: deposição eletroquímica de uma camada protetora resistente à corrosão sobre um metal.
- Galvanização: processo de eletrodeposição que consiste no revestimento de peças metálicas pelo zinco ou ligas de zinco para impedir a corrosão da peça metálica. Para saber mais, clique aqui.
- Cromação: também chamado de cromagem, consiste em um processo de eletrodeposição que reveste peças metálicas pelo cromo, assim impedindo a corrosão da peça metálica.
- Eletrólise: processo eletroquímico não espontâneo em que uma mudança química é produzida pela passagem de corrente elétrica por um líquido. A eletrólise pode ser ígnea (em meio não aquoso) ou aquosa (em meio aquoso). Na eletrólise, a d.d.p. é sempre negativa. Saiba mais clicando aqui.
Importância de eletroquímica
A eletroquímica está muito atrelada às demandas da sociedade, sendo uma parte essencial da tecnologia moderna. Células eletroquímicas cada vez mais complexas e eficientes estão sendo produzidas para a geração de energia de eletroportáteis, como celulares, tablets, notebooks, entre outros, além de veículos, como as bicicletas elétricas e os carros elétricos.
A utilização de pilhas e baterias torna o nosso mundo mais fácil, trazendo mais conforto e praticidade. Se não houvesse tais dispositivos, tudo que necessitasse de corrente elétrica teria que ser ligado à tomada. Imagine um controle remoto nessas condições? Baterias com autonomia cada vez maior, e tamanho cada vez menor e mais leve, permitiram que eletroeletrônicos fascinantes pudessem ser desenvolvidos sem a necessidade da utilização de fios.

Além disso, a eletroquímica é muito importante no ramo industrial, principalmente por conta da eletrólise, que propicia a produção de metais com elevado grau de pureza.
O estudo e o entendimento da corrosão também auxiliam cidades e indústrias. Por exemplo, estima-se que 30% da produção mundial de aço e ferro sejam perdidos com a corrosão, o que pode corresponder de 1 a 5% do PIB de um país. Em 2019, por exemplo, o Brasil gastou cerca de R$ 290 bilhões para manutenção contra corrosão, algo que significa cerca de 4% do seu PIB.
Saiba mais: Como a ferrugem ocorre?
Questões de eletroquímica no Enem
Questão 1. (Enem/2024) Células a combustível microbianas (CCM) são capazes de gerar eletricidade a partir de águas residuárias urbanas e agroindustriais. As CCM são compostas de duas câmaras. Numa delas, onde ocorre o tratamento da matéria orgânica, as bactérias eletrogênicas crescem formando um biofilme e se alimentam dos poluentes presentes no efluente. Ao se alimentarem, essas bactérias geram uma corrente elétrica que percorre o material sobre o qual elas formaram o biofilme. Um fio condutor externo possibilita a migração dessa corrente para uma segunda câmara, promovendo uma reação química. A figura esquematiza uma CCM e as reações envolvidas.
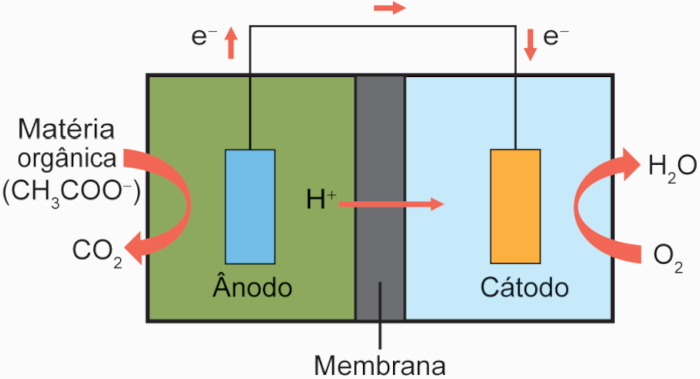
CH3COO− (aq) + 2 H2O (l) → 2 CO2 (g) + 7 H+ (aq) + 8 e−
4 H+ (aq) + O2 (g) + 4 e− → 2 H2O (l)
QUINTO, A. C. Biobaterias geram eletricidade a partir de esgoto sanitário e efluentes agroindustriais. Disponível em: https://jornal.usp.br. Acesso em: 1 dez. 2021 (adaptado).
Qual das equações representa a reação global que ocorre durante o funcionamento dessa CCM?
A) CH3COO− (aq) + O2 (g) → 2 CO2 (g) + 3 H+ (aq)
B) CO2 (g) + O2 (g) + H+ (aq) → H2O (l) + CH3COO− (aq)
C) CH3COO− (aq) + H+ (aq) + 2 O2 (g) → 2 CO2 (g) + 2 H2O (l)
D) CH3COO− (aq) + 6 H2O (l) → 2 CO2 (g) + 2 O2 (g) + 15 H+ (aq)
E) 2 CO2 (g) + 11 H+ (aq) + O2 (g) → CH3COO− (aq) + 4 H2O (l)
Resposta: Letra C.
A equação global da CCM é a soma das reações anódica e catódica, porém sem a presença dos elétrons. Para tal, os números de elétrons em ambas as reações devem ser iguais, de modo que, ao se somarem, sejam anulados.
A primeira reação, de oxidação, tem a produção de 8 elétrons, enquanto a segunda reação, de redução, tem a utilização de 4 elétrons. Assim, para se igualar o número de elétrons, a segunda reação deve ser dobrada, ficando assim:
8 H+ (aq) + 2 O2 (g) + 8 e− → 4 H2O (l)
As substâncias que estão de lados opostos devem ser subtraídas, enquanto as que estão do mesmo lado em ambas as equações devem ser somadas.
O somatório das duas reações fica:
Reação anódica: CH3COO− (aq) + 2 H2O (l) → 2 CO2 (g) + 7 H+ (aq) + 8 e−
Reação catódica: 8 H+ (aq) + 2 O2 (g) + 8 e− → 4 H2O (l)
Reação global: CH3COO− (aq) + H+ (aq) + 2 O2 (g) → 2 CO2 (g) + 2 H2O (g)
Questão 2. (Enem/2022) A nanotecnologia é responsável pelo aprimoramento de diversos materiais, incluindo os que são impactados com a presença de poluentes e da umidade na atmosfera, causadores de corrosão. O processo de corrosão é espontâneo e provoca a deterioração de metais como o ferro, que, em presença de oxigênio e água, sofre oxidação, conforme ilustra a equação química:
4 Fe (s) + 2 H2O (l) + 3 O2 (g) → 2 Fe2O3·H2O (s)
Uma forma de garantir a durabilidade da estrutura metálica e a sua resistência à umidade consiste na deposição de filmes finos nanocerâmicos à base de zircônia (ZrO2) e alumina (Al2O3) sobre a superfície do objeto que se deseja proteger.
CLEMENTE, G.A. B. F. et al. O uso de materiais híbridos ou nanocompósitos como revestimentos anticorrosivos do aço. Química Nova, n. 9, 2021 (adaptado).
Essa nanotecnologia aplicada na proteção contra a corrosão se baseia no(a)
A) proteção catódica, que utiliza um metal fortemente redutor.
B) uso de metais de sacrifício, que se oxidam no lugar do ferro.
C) passivação do ferro, que fica revestido pelo seu próprio óxido.
D) efeito de barreira, que impede o contato com o agente oxidante.
E) galvanização, que usa outros metais de menor potencial de redução.
Resposta: Letra D.
A deposição de filmes à base de zircônia e alumina reveste, por completo, todo o metal, assim formando uma camada que impede o contato do metal com o meio corrosivo/oxidante.
Questão 3. (Enem/2021) O quadro lista alguns dispositivos eletrônicos que estão presentes no dia a dia, bem como a faixa de força eletromotriz necessária ao seu funcionamento.
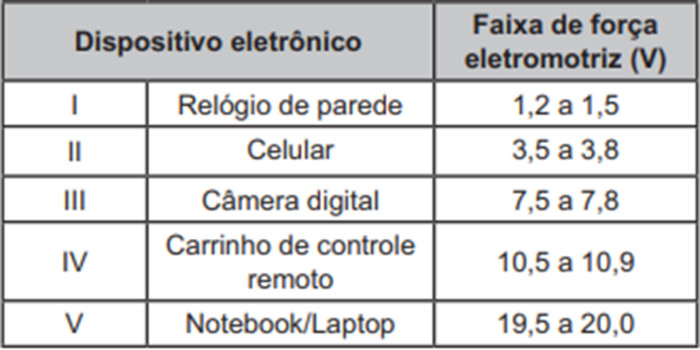
Considere que uma bateria é construída pela associação em série de três pilhas de lítio-iodo, nas condições-padrão, conforme as semiequações de redução apresentadas.
I2 + 2 e− → 2 I− E° = +0,54 V
Li+ + e− → Li E° = −3,05 V
Essa bateria é adequada para o funcionamento de qual dispositivo eletrônico?
A) I.
B) II.
C) III.
D) IV.
E) V.
Resposta: Letra D.
A d.d.p. de uma pilha lítio-iodo pode ser calculada da seguinte forma:
d.d.p. = E°R (maior) – E°R (menor)
d.d.p. = +0,54 – (− 3,05)
d.d.p. = +3,59 V
Contudo, a bateria é constituída pela associação em série de três pilhas desse modelo. Na associação em série, a voltagem se soma, portanto, à d.d.p. da bateria, igual a 3\(\cdot\)(+3,59 V), sendo igual, portanto, a +10,77 V.
Com essa voltagem, a bateria é adequada para o funcionamento do carrinho de controle remoto.
Questão 4. (Enem PPL/2020) Os tanques de armazenamento de gasolina podem, com o tempo, sofrer processos oxidativos, resultando na contaminação do combustível e do solo à sua volta. Uma forma de evitar tais problemas econômicos e ambientais é utilizar preferencialmente metais de sacrifício, protegendo os tanques de armazenamento.
Suponha que seja necessário usar um metal de sacrifício em um tanque de aço (liga de ferro-carbono). Considere as semirreações de redução e seus respectivos potenciais padrão.
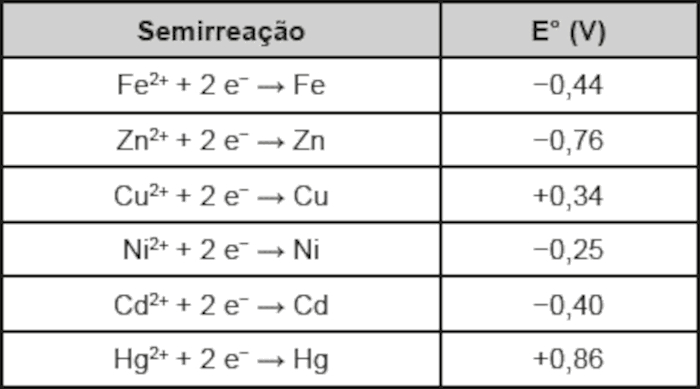
Dos metais citados, o que garantirá proteção ao tanque de aço é o
A) zinco.
B) cobre.
C) níquel.
D) cádmio.
E) mercúrio.
Resposta: Letra A.
O ideal é fazer a proteção de um tanque de aço, em que o metal presente é o ferro. Para tal, propõe-se a técnica do metal de sacrifício, um metal que irá se oxidar mais facilmente que o ferro.
Para se oxidar mais facilmente que o ferro, o metal deve ter um menor potencial de redução que o ferro, pois, quanto menor o potencial de redução, menor a tendência a se reduzir e, por conseguinte, maior a tendência a se oxidar.
Dos elementos presentes na tabela, o que apresenta menor potencial de redução que o ferro é o zinco (Zn).
Questão 5. (Enem Digital/2020) As pilhas recarregáveis, bastante utilizadas atualmente, são formadas por sistemas que atuam como uma célula galvânica, enquanto estão sendo descarregadas, e como célula eletrolítica, quando estão sendo recarregadas.
Uma pilha é formada pelos elementos níquel e cádmio e seu carregador deve fornecer uma diferença de potencial mínima para promover a recarga. Quanto maior a diferença de potencial gerada pelo carregador, maior será o seu custo. Considere os valores de potencial padrão de redução dessas espécies:
Ni2+ (aq) + 2 e− ⇌ Ni (s) E° = −0,230 V
Cd2+ (aq) + 2 e− ⇌ Cd (s) E° = −0,402 V
Teoricamente, para que um carregador seja ao mesmo tempo eficiente e tenha o menor preço, a diferença de potencial mínima, em volt, que ele deve superar é de
A) 0,086.
B) 0,172.
C) 0,316.
D) 0,632.
E) 1,264.
Resposta: Letra B.
O carregador deve superar, pelo menos, a d.d.p. da pilha de níquel e cádmio. Essa é a d.d.p. mínima que ele deve promover, tendo, assim, um menor custo. A d.d.p. da pilha de níquel e cádmio pode ser calculada da seguinte forma:
d.d.p. = E°R (maior) – E°R (menor)
d.d.p. = − 0,230 – (− 0,402)
d.d.p. = + 0,172 V
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. Príncípios de Química: Questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
INEP. Instituto Nacional de Estudos e Pesquisas Educacionais Anísio Teixeira. Ministério da Educação, Matriz de Referência ENEM. Disponível em: https://download.inep.gov.br/download/enem/matriz_referencia.pdf
INTERNATIONAL OF PURE AND APPLIED CHEMISTRY – IUPAC. Compendium of Chemical Terminology – IUPAC Recommendations (Gold Book). Disponível em: https://goldbook.iupac.org/


