Propriedades coligativas
As propriedades coligativas são propriedades que sofrem alteração pela adição de um soluto não volátil a um solvente. A magnitude dessa alteração está associada à quantidade de soluto adicionado, ou seja, do número de partículas em solução.
As propriedades coligativas são:
A lei de Raoult determina matematicamente o grau de variação de tais propriedades.
Leia também: O que é uma solução?
Resumo sobre as propriedades coligativas
-
As propriedades coligativas são propriedades que se alteram pela adição de um soluto não volátil a um solvente puro.
-
A intensidade da alteração dessas propriedades depende da quantidade de partículas em solução.
-
A natureza do soluto não interfere nas propriedades coligativas.
-
A variação da pressão de vapor do solvente em razão da presença do soluto é o efeito tonoscópico.
-
O aumento do ponto de ebulição pela presença de soluto se deve ao efeito ebulioscópico.
-
A redução na temperatura de congelamento pela presença de partículas do soluto está associada ao efeito crioscópico.
-
A variação da pressão osmótica entre um solvente puro e uma solução também é uma propriedade coligativa.
-
A lei de Raoult justifica matematicamente as alterações nas propriedades coligativas em termos da variação de pressão de vapor parcial do solvente.
Videoaula sobre propriedades coligativas
O que são propriedades coligativas?
As propriedades coligativas são as propriedades de um solvente puro que se alteram pela adição de um soluto não volátil ao se formar uma solução.
O efeito coligativo não depende da natureza do soluto que é adicionado, mas sim da quantidade de partículas presentes. Por exemplo, soluções aquosas de cloreto de sódio (NaCl) e cloreto de cálcio (CaCl2) em concentração de 1 mol L-1 terão suas propriedades coligativas alteradas em diferentes intensidades. Isso se explica pelo número de partículas formado na dissociação de cada sal.
A temperatura de congelamento da água doce é 0 °C. No entanto, a água salgada dos mares congela em temperatura inferior a essa, dependendo da quantidade de sais dissolvidos, algo em torno de -1,6 °C a -1,9 °C.
O que são solventes e solutos?
Em Química, as soluções se referem às misturas homogêneas, que são formadas por soluto e solvente.
-
Soluto: é a substância dissolvida, isto é, aquela que se distribui em outra. Os solutos são formados por partículas muito pequenas, com diâmetros na ordem de até 1 nanômetro (nm). A dimensão extremamente reduzida garante que a solução apresente uma única fase (mesmo se observada ao microscópio) e que as partículas do solvente não sofram sedimentação com o passar do tempo.
-
Solvente: é a substância dispersante e possui a capacidade de dissolver o soluto, permitindo que as partículas do soluto se distribuam em seu interior. Normalmente é um líquido.
A salmoura é uma mistura entre água e sal, em que a água é o solvente e o sal é o soluto.
Tratando-se de propriedades coligativas, o efeito observado se deve à presença de um soluto não volátil, que é um soluto com elevado ponto de ebulição, sendo muito difícil a sua evaporação (ou volatilização). Exemplos de solutos não voláteis são o cloreto de sódio (sal de cozinha), o açúcar, o cloreto de magnésio, etanol, etilenoglicol, entre outros.
Leia também: Diferenças entre substâncias e misturas
Quais são as propriedades coligativas?
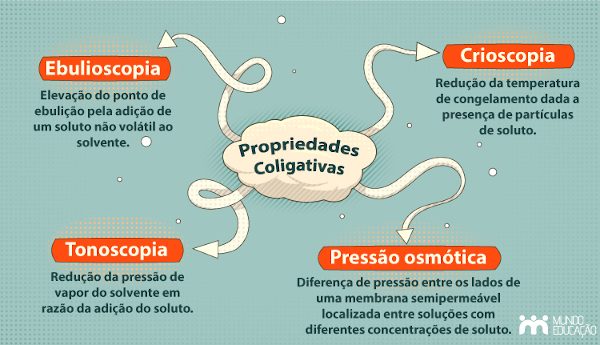
As propriedades coligativas se dividem em quatro tipos: tonoscopia, ebulioscopia, crioscopia e pressão osmótica.
-
Tonoscopia
O efeito coligativo observado é a diminuição da pressão de vapor da solução ao ser adicionado um soluto não volátil ao solvente puro.
Isso se explica pela força atrativa entre as partículas do solvente e do soluto, em razão de interações intermoleculares, dificultando a passagem de moléculas do solvente do estado líquido para o estado de vapor, quando considerada a mesma temperatura.
Com a existência de menor quantidade de moléculas do solvente na forma gasosa, naturalmente há uma redução da pressão de vapor.
Isso significa que quanto maior a quantidade de um soluto em um mesmo volume de solvente, mais difícil é a evaporação, em razão da redução da pressão de vapor.
Se dois copos forem deixados em ambiente aberto, um contendo água e o outro preenchido por uma solução de água e açúcar, este último levará mais tempo para que o líquido evapore.
-
Ebulioscopia
O efeito ebulioscópico é a elevação do ponto de ebulição do solvente pela adição do soluto não volátil.
Como explicado para o efeito da tonoscopia, a presença do soluto dificulta a passagem de moléculas do solvente do estado líquido para a fase de vapor, reduzindo a pressão de vapor e, consequentemente, elevando a temperatura necessária para que a ebulição aconteça. Pressão de vapor e ponto de ebulição são propriedades correlacionadas.
Um clássico exemplo desse efeito é o aumento da temperatura de ebulição da água ao ser adicionada uma quantidade de sal de cozinha. Se uma porção de água está em estágio de fervura e é adicionada a ela uma dose de sal, a fervura imediatamente cessa e apenas recomeçará quando a solução chegar a uma maior temperatura.
-
Crioscopia
Nesse caso, ocorre uma redução no ponto de congelamento do solvente em razão da presença de um soluto não volátil. As partículas do soluto interferem na formação da estrutura sólida congelada, e o efeito observado é a redução da temperatura em que tal congelamento de fato acontece. Assim, quanto maior a concentração de soluto dissolvido, menor será a temperatura de solidificação.
É devido ao efeito crioscópico que se torna possível a existência de icebergs de água doce em meio aos oceanos, formados por água salgada em estado líquido, em uma mesma temperatura e pressão atmosférica.
Uma aplicação extremamente útil desse efeito é explorada em regiões muito frias do planeta, em que há a formação de gelo sobre ruas e estradas, tornado o trânsito perigoso. Nesses locais, é comum espalhar algum tipo de sal, como cloreto de sódio (NaCl) ou cloreto de cálcio (CaCl2), sobre o gelo formado, fazendo-o retornar ao estado líquido pela redução da temperatura de congelamento da água.
Seguindo o mesmo raciocínio, é comum a adição de substâncias anticongelantes em combustíveis nos automóveis usados em lugares muito frios. A presença do soluto reduz o ponto de congelamento do combustível.
O diagrama abaixo representa os efeitos das propriedades coligativas de tonoscopia, ebulioscopia e crioscopia.
-
Pressão osmótica
É o efeito de variação da pressão osmótica entre o solvente puro e uma solução ou entre soluções com diferentes concentrações de soluto em relação a uma membrana semipermeável.
O solvente, naturalmente, tende a fluir para o meio de maior concentração de soluto (através da membrana), buscando uma condição de equilíbrio em que a pressão osmótica se iguale.
A membrana semipermeável, nesse caso, se refere a qualquer barreira física que permita a passagem de solvente (e não de partículas de soluto), tais como membranas biológicas (citoplasma) ou poliméricas (celofane).
Um bom exemplo de aplicação da pressão osmótica é o hábito milenar de utilizar grande quantidade de sal na conservação de alimentos. Com a aplicação de sal sobre a carne, por exemplo, a concentração de soluto não volátil será muito maior na parte externa do que interna, favorecendo o processo de osmose do solvente (água) para o lado externo. Com a diminuição da quantidade de água no interior do alimento, a proliferação de microrganismos é drasticamente reduzida.
A carne de sol e a carne-seca, pratos típicos nordestinos, requerem grande quantidade de sal para conservação.
Você também consegue perceber esse efeito ao temperar com sal uma salada de alface e observar a aparência das folhas algumas horas depois. Elas estarão desidratadas, com aparência de murchas e com as folhas escurecidas.
Lei de Raoult
A Lei de Raoult foi determinada experimentalmente e descreve matematicamente o efeito da adição de um soluto não volátil a um solvente puro. Segundo os estudos de Raoult, a pressão de vapor total de uma solução é a soma das pressões de vapor de cada um dos componentes:
A pressão de vapor parcial de cada componente é expressa como:
-
é a pressão de vapor do componente puro; -
é a fração molar do componente na solução e varia de 0 a 1, sendo = 1 quando há apenas 1 componente no sistema.
Com isso, o comportamento das propriedades coligativas é explicado. Afinal, quando o solvente está em seu estado puro, sua fração molar é igual a 1, e a pressão total do sistema equivale à pressão de vapor do solvente. Quando um soluto não volátil é adicionado ao solvente, formando uma solução, a fração molar do solvente será menor do que 1, e sua contribuição para a pressão total será menor.
Como o soluto não volátil possui exatamente a característica de ser pouco volátil, uma quantidade mínima de moléculas estará no estado de vapor, podendo ser considerado que o soluto praticamente não contribui para a pressão total do sistema.
Portanto, a adição de um soluto não volátil a um solvente promove a redução da pressão de vapor do solvente puro, uma vez que sua fração molar é reduzida.
A lei de Raout é válida para soluções diluídas, denominadas soluções ideais. Em soluções concentradas, a lei de Raoult sofre desvios em razão de interações significativas entre as moléculas.
Leia também: Fatores que alteram a pressão de vapor de um líquido
Exercícios resolvidos sobre propriedades coligativas
Questão 1
(Fuvest-SP) Sob mesma pressão, comparando-se as temperaturas de ebulição e do congelamento de uma solução aquosa de açúcar com as correspondentes para a água pura, tem-se:
a) valores maiores para as temperaturas referentes à solução.
b) valores menores para as temperaturas referentes à solução.
c) maior temperatura de ebulição e menor temperatura de congelamento para a solução.
d) menor temperatura de ebulição e maior temperatura de congelamento para a solução.
e) a mesma temperatura de ebulição e diferentes temperaturas de congelamento para a solução e a água.
Resolução:
Letra C
A adição de um soluto não volátil (açúcar) a um solvente (água) formará uma solução que terá maior ponto de ebulição (ebulioscopia) e menor ponto de congelamento ou de fusão (crioscopia) em comparação ao solvente puro. As propriedades que se alteram pela adição de soluto ao solvente são conhecidas como propriedades coligativas.
Questão 2
(Unesp) Comparando-se os pontos de congelação de três soluções aquosas diluídas de KNO3, MgSO4 e Cr(NO3)3, de mesma concentração em mol/L, verifica-se que:
a) as três soluções têm o mesmo ponto de congelação.
b) os pontos de congelação decrescem na seguinte ordem: KNO3 < MgSO4 < Cr(NO3)3.
c) a solução de Cr(NO3)3 tem ponto de congelação mais baixo que as soluções dos outros dois sais.
d) o ponto de congelação de cada solução depende de seu volume.
e) as três soluções têm pontos de congelação maiores que o da água.
Resolução:
Letra C
A adição de soluto não volátil a um solvente puro altera algumas propriedades, como pressão de vapor, ponto de ebulição e de congelamento. A intensidade de variação dessas propriedades, conhecidas como propriedades coligativas, depende da quantidade de partículas de soluto, e não de sua natureza química.
As soluções formadas, apesar de serem adicionadas em idêntica concentração do sal, terão suas propriedades coligativas alteradas em diferentes intensidades, pois cada sal libera em solução diferentes quantidades de partículas. Veja:
Portanto, a solução de Cr(NO3)3 terá menor ponto de congelamento, pois possui maior número de partículas em solução



