Nitratos
Os nitratos são um conjunto de compostos que possuem o íon nitrato (NO3-) em sua composição. Os nitratos possuem como fortes características a solubilidade de água e a baixa reatividade.
Esses compostos têm função primordial no ciclo do nitrogênio, atuando como principal fonte de nitrogênio para os vegetais. Por isso, os nitratos também são a matéria-prima da fabricação de fertilizantes.
Outras aplicações desses compostos são o uso como conservantes alimentícios em produtos embutidos, fabricação de explosivos e de fogos de artifícios. Além disso, nitratos orgânicos possuem ação vasodilatadora no organismo e, por isso, são empregados na produção de diferentes fármacos.
Leia também: Isonitrilos — compostos orgânicos nitrogenados que apresentam o grupo cianeto ligado a radicais orgânicos
Resumo sobre nitratos
-
Nitratos são um grupo de compostos que possuem o íon nitrato (NO3‑).
-
O íon nitrato possui três ligações N-O idênticas, distribuídas em uma geometria trigonal plana.
-
A maioria dos nitratos é solúvel em água.
-
Os nitratos possuem grande estabilidade química em razão do efeito de ressonância.
-
Ocorrem de forma natural, fazendo parte do ciclo do nitrogênio
-
Atuam como a principal fonte de nitrogênio para os vegetais.
-
Os nitratos são usados na fabricação de fertilizantes, explosivos, conservantes alimentícios e alguns tipos de fármacos.
-
O uso excessivo de fertilizantes pode contaminar corpos d’água com nitrato.
-
Nitratos são encontrados em alimentos embutidos e vegetais como beterraba, cenoura, espinafre etc.
O que são os nitratos?
Nitratos são compostos formados pelo ânion poliatômico nitrato, representado por NO3-. Os nitratos podem ser inorgânicos ou orgânicos, sendo os primeiros os mais comuns.
O íon nitrato é formado por um átomo de nitrogênio central, com número de oxidação (Nox) igual a +5, ligado covalentemente a átomos de oxigênio idênticos, arranjados em uma geometria trigonal planar, com ângulos de ligação de 120° e comprimento de ligação de 123 pm.
Monovalente, o íon nitrato tem carga formal -1, a qual está uniformemente distribuída pelos três átomos de oxigênio. Os elétrons π do nitrato não pertencem a uma única ligação N-O, mas ficam distribuídos por todas as ligações covalentes. Esse fenômeno é conhecido como efeito de ressonância e contribui para a estabilidade do ânion nitrato.
Três estruturas de ressonância são possíveis para o íon nitrato e estão demonstradas abaixo. Isso significa que esse ânion existe sob a forma combinada entre essas três formas e é formalmente representado pelo seu híbrido de ressonância.
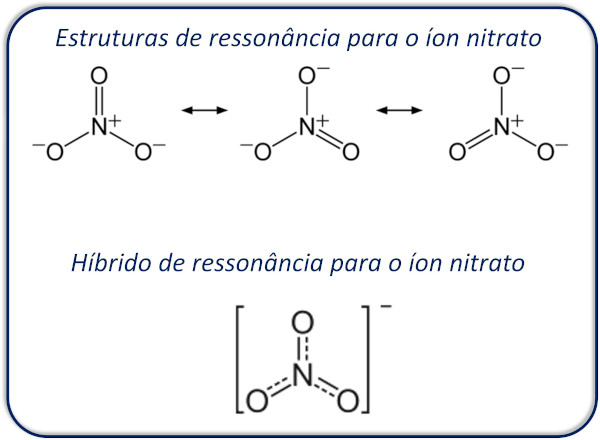
Para a formação dos sais de nitrato, o ânion NO3- se combina com íons de carga positiva, geralmente cátions metálicos, como o sódio (Na+) ou o potássio (K+).
O termo “nitrato” é usado em razão de esses íons serem derivados no ácido nítrico (NH3). De acordo com a regra de nomenclatura de oxiácidos da Iupac, quando o ácido possuir sufixo em “-ico”, o ânion derivado será nomeado com sufixo “-ato”.
Quais são as características dos nitratos?
Os nitratos ocorrem naturalmente pela fixação de nitrogênio e oxigênio atmosféricos, função desempenhada, principalmente, por alguns tipos de bactérias.
Uma característica marcante é que a maioria dos nitratos inorgânicos é solúvel em água. Isso se explica pela relação entre a carga do íon e seu tamanho.
De modo geral, ânions com relação carga/raio pequena possuem sais de elevada solubilidade, mesmo que unidos a cátions pequenos e de elevada carga. Isso se deve a efeitos de interação mais intensa do sal com moléculas da água do que com as próprias moléculas que formam a estrutura cristalina do sólido.
|
Tabela de solubilidade de alguns sais inorgânicos em água (25 °C) |
|
|
Sal |
Solubilidade (g de sal em 100 g de água) |
|
NaNO3 |
91,2 |
|
KNO3 |
38,3 |
|
NH4NO3 |
212,5 |
|
AgNO3 |
234,4 |
|
Mg(NO3)2 |
712 |
Em razão do efeito de ressonância, o íon nitrato possui uma estabilidade química considerável, sendo muito pouco reativo. Por exemplo, no organismo humano, íons nitrato não participam diretamente de nenhum processo metabólico. Para isso, são convertidos a íons nitrito (NO2-).
Os íons nitrato participam do ciclo biogeoquímico do nitrogênio. O ciclo do nitrogênio é formado por vários processos químicos executados, na maioria das vezes, por microrganismos, os quais trabalham convertendo o nitrogênio da atmosfera (N2) em íons nitrato e íons amônio (NH4+), que são formas mais bem assimiladas pelos vegetais.
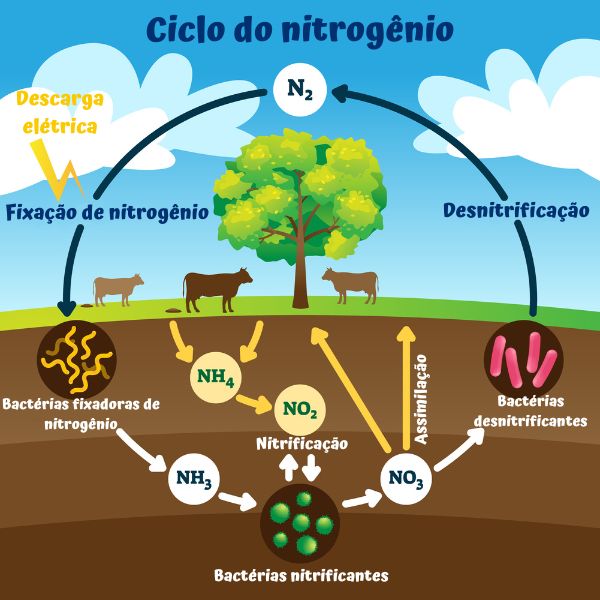
Quais são os nitratos?
Os nitratos podem ser de origem inorgânica ou orgânica.
-
Nitratos inorgânicos: são sais geralmente formados por cátions metálicos, sendo encontrados naturalmente na água e no solo. Os vegetais folhosos verde-escuros e a beterraba são ricos em nitratos inorgânicos.
-
Nitratos orgânicos: mantêm a característica de boa estabilidade química, sendo pouco solúveis em água. São substâncias sintéticas (produzidas em laboratório) formadas por reações de nitro-oxilação, que se dá pela combinação entre um ácido e um grupo álcool. O produto dessa reação são ésteres de ácido nítrico (RONO2), em que R é qualquer segmento de cadeia orgânico: \(\mathbf{ROH+HNO_3 ⟶RONO_2}\). Ou seja, nitratos orgânicos são hidrocarbonetos que possuem o radical -ONO2. Essa configuração química atribui aos nitratos orgânicos efeitos biológicos e, por isso, são empregados na síntese de fármacos.
Veja também: Anidridos ácidos — compostos que podem originar ácidos inorgânicos quando reagem com a água
Para que servem os nitratos?
Os nitratos possuem uma variedade de aplicações e usos. Uma das principais áreas de consumo de nitratos é a agricultura. Os sais de nitrato são a base de fabricação de fertilizantes, que têm ampla aplicabilidade em razão da elevada solubilidade e capacidade de biodegradação. Sais de amônio, sódio, cálcio, magnésio e potássio são os nitratos mais empregados na agricultura, atuando como fonte de nitrogênio às plantas.
Esses compostos são empregados como agentes oxidantes em explosivos, em razão da rápida oxidação dos compostos de carbono, liberando grandes volumes de gases. Utilizando essa mesma característica, sais de nitrato são usados como propelente de foguetes e ativadores de fogos de artifício.
Na área da saúde, nitratos orgânicos são usados em fármacos para o tratamento e profilaxia de síndromes coronarianas e em ataques cardíacos, graças à sua função de expandir os vasos sanguíneos. Essa classe de fármacos é conhecida como nitrovasodilatadora.
No setor alimentício, os produtos embutidos (presunto, queijo, salame, linguiça, salsicha etc.) empregam nitratos como fixadores de cor ou conservantes, contendo a proliferação de microrganismos.
Precauções com os nitratos
Nitratos são encontrados em alimentos embutidos e em alguns tipos de vegetais. O nitrato em si é pouco reativo, no entanto pode haver a formação de nitritos por meio de nitratos. Os nitritos formados pelos nitratos são mais reativos e podem desencadear alguns processos danosos à saúde.
Os efeitos negativos no organismo derivados do consumo de nitrato se dividem, basicamente, em dois. Um deles é o desenvolvimento de câncer, pois no organismo, nitratos são naturalmente convertidos em nitritos por bactérias presentes no sistema digestivo. Ao chegar ao estômago, os nitritos se combinam com o ácido clorídrico do suco gástrico, originando substâncias conhecidas como nitrosaminas, as quais são associadas a casos de câncer.
Outro efeito negativo no organismo é o desenvolvimento de metemoglobinemia, uma doença associada a distorções de funcionamento dos glóbulos vermelhos (hemoglobina), os quais mantêm o íon ferro em estado de oxidação +3, prejudicando o transporte de oxigênio no organismo (que ocorre pela ligação ao íon Fe2+). Em bebês, esse quadro clínico é conhecido como síndrome do bebê azul.
Além desses aspectos, a forma de preparação de alguns alimentos também pode contribuir para o consumo de nitratos, como o cozimento/fritura de alimentos ricos em proteína em fogo alto.

Contudo, os estudos indicam que fontes de nitrato de origem vegetal não apresentam riscos consideráveis à saúde. Isso porque vegetais possuem baixo teor de proteínas. Na realidade, a ingestão de nitratos por meio de verduras e legumes contribui para a proteção do organismo, participando do processo de formação do óxido nitroso, composto importante para o combate a doenças, como disfunções cardíacas e cânceres, em razão de seu efeito vasodilatador.
Outra forma comum de exposição aos nitratos é pelo consumo de água contaminada. No Brasil, esse tipo de exposição não é raro, dado o alto volume de fertilizantes empregados para manter as lavouras e plantações. Como os nitratos são muito solúveis, lixiviam com facilidade, alcançando lençóis freáticos e corpos d’água.
→ Acidente com nitrato de amônio

Como destacado anteriormente, nitratos são estáveis quimicamente. No entanto, recentemente houve um episódio de acidente explosivo envolvendo o nitrato de amônio (NH4NO3) no porto de Beirute, capital do Líbano, que deixou a cidade parcialmente destruída. Na ocasião, não foi o sal de nitrato que reagiu e explodiu.
Na realidade, o calor gerado por um incêndio foi suficiente para decompor o NH4NO3, gerando elevado volume de gases que se expandem com rapidez e de forma explosiva. O poder oxidante desse composto químico contribuiu para a gravidade do acidente.
Alimentos com nitrato

Os alimentos embutidos e alguns tipos de vegetais são ricas fontes de nitrato. Porém, o consumo de nitrato via alimentos processados é danoso ao organismo, ao contrário do verificado para o consumo de vegetais. Alguns alimentos ricos em nitratos são:
-
beterraba;
-
cenoura;
-
espinafre;
-
rúcula;
-
aipo;
-
brócolis;
-
coentro;
-
alface;
-
acelga;
-
manjericão;
-
bacon;
-
salame;
-
presunto;
-
alguns queijos;
-
salsicha;
-
peito de peru;
-
mortadela;
-
outros tipos de carnes processadas.
Importante: Verduras e legumes orgânicos tendem a possuir teores menores de nitrato, uma vez que são produzidos sem o uso de fertilizantes sintéticos. Os vegetais absorvem os nitratos do solo em que são cultivados.
Acesse também: Aminas — compostos orgânicos nitrogenados que derivam da substância amônia (NH3)
Exercícios resolvidos sobre nitratos
Questão 1
(PUC) Uma das maiores preocupações do ser humano é relativa à alimentação. As pessoas desejam alimentos não apenas saborosos, como também saudáveis e seguros. Nesse sentido, conservantes alimentícios desempenham um importante papel. Nitritos e nitratos, por exemplo, são usados em produtos cárneos para impedir a proliferação de bactérias como o Clostridium botulinum, causador de intoxicações alimentares perigosíssimas. Presuntos, salames e linguiças são típicos produtos cárneos conservados com auxílio de nitritos e nitratos. Os nitritos e nitratos conferem a esses produtos uma coloração vermelha ou rosada intensa, que não desaparece mediante aquecimento, ao contrário do que ocorre com carnes frescas, que adquirem cor marrom.
Em relação aos nitritos e nitratos, é correto afirmar que:
A) nitrato de sódio é um composto químico ácido.
B) nitrato de sódio e nitrito de sódio são constituídos pelos mesmos elementos.
C) íons nitrato e nitrito são representados, respectivamente, por NO2− e NO3-.
D) íons nitratos são mais reativos do que íons nitrito.
E) nitritos e nitratos são parcialmente removidos de alimentos pela fritura, pois o contato com o azeite solubiliza seus íons.
Resolução:
Alternativa B
Item A incorreto, pois o nitrato de sódio é um sal inorgânico.
Item B correto. A fórmula química do nitrato de sódio é NaNO3 e do nitrito de sódio é NaNO2. Portanto, ambos os compostos são formados pelos mesmos elementos químicos.
Item C incorreto. Íon nitrato é representado como NO3- e íon nitrito como NO2-.
Item D incorreto. Íons nitrato são muito estáveis e pouco reativos.
Item E incorreto. Nitratos e nitritos não são removidos de alimentos pela fritura. Na realidade, íons nitrato podem ser convertidos a íons nitrito.
Questão 2
(EBMSP - adaptada) Com relação à estrutura e às propriedades do nitrato de amônio, é correto afirmar:
A) O íon nitrato é diatômico e a posição dos átomos na estrutura forma uma geometria trigonal planar.
B) A estrutura cristalina do sal NH4NO3(s) é constituída por um número de cátions maior do que o número de ânions.
C) A dissolução do nitrato de amônio em água produz uma solução de pH maior do que 7,0, devido à hidrólise do íon amônio.
D) Os átomos de nitrogênio presentes no nitrato de amônio apresentam um par de elétrons não ligantes na camada de valência.
Resolução:
Alternativa A
Item A correto. O íon nitrato poliatômico e a orientação dos átomos forma uma estrutura trigonal planar.
Item B incorreto. O NH4NO3 é formado por 1 cátion (NH4+) e 1 ânion (NO3-).
Item C incorreto. A dissociação de NH4NO3 forma uma solução de pH menor do que 7, ou seja, ácida. Isso se justifica pela formação do ácido forte HNO3.
\(\mathbf{NH_4NO_3+\color{red}{ H_2 O} ⇄ NH_4 \color{red}{OH}+\color{red}{H}NO_3^-}\)
Item D correto. Os átomos de nitrogênio presentes no nitrato de amônio NÃO apresentam um par de elétrons não ligantes na camada de valência.
Crédito de imagem
[1] Hussein Kasir / Shutterstock

