Alcenos
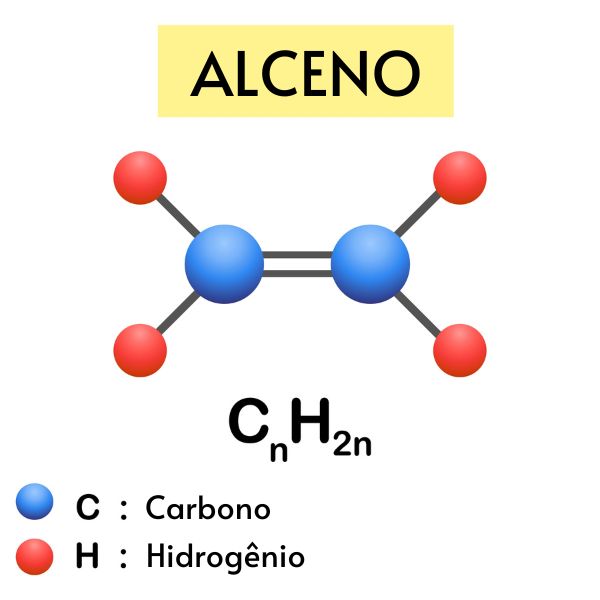
Os alcenos são hidrocarbonetos insaturados que possuem ao menos uma ligação dupla entre carbonos. A presença da ligação dupla confere aos alcenos caráter apolar e evidenciada reatividade, podendo participar de reações de adição e de oxidação.
O etileno é o alceno mais comum e mais simples, sendo a substância responsável pelo amadurecimento das frutas. Esse composto também possui grande importância na indústria química, sendo a matéria-prima para a síntese do polímero polietileno.
Veja também: Alcadienos — hidrocarbonetos de cadeia aberta com duas duplas ligações na cadeia
Resumo sobre alcenos
-
Alcenos são hidrocarbonetos que possuem ligação dupla entre carbonos.
-
A presença da dupla ligação confere aos alcenos elevada reatividade, em comparação aos alcanos.
-
Alcenos sofrem reações de adição e de oxidação com facilidade.
-
A isomeria geométrica ocorre em alcenos. O termo cis é empregado para se referir aos ligantes posicionados do mesmo lado do eixo da ligação dupla.
-
O termo trans é empregado para identificar ligantes posicionados em lados opostos ao eixo da ligação.
-
A nomenclatura de alcenos é dada por prefixo + en + o. O prefixo se refere ao número de átomos de carbono na cadeia.
-
A fórmula geral para os alcenos acíclicos (cadeia aberta) é CnH2n, sendo n o número de carbonos.
-
Para alcenos cíclicos, isto é, de cadeia fechada, a fórmula geral é CnH2n-2.
-
Os alcenos formados por até cinco átomos de carbono podem ser obtidos por meio do refino do petróleo.
-
Os alcenos de cadeia maior podem ser formados por craqueamento de alcanos, desidratação de álcoois e hidrogenação de alcinos.
-
O alceno etileno é naturalmente produzido pelas frutas e é responsável pelo seu amadurecimento.
-
O etileno é a base do polímero polietileno, usado na fabricação de filmes plásticos, sacolas, frascos etc.
-
Outros alcenos são empregados na indústria química, como o poliestireno.
O que são alcenos?
Os alcenos, que também podem ser conhecidos como olefinas, pertencem à classe dos hidrocarbonetos e são compostos insaturados que possuem ao menos uma ligação dupla carbono-carbono. Os hidrocarbonetos são compostos orgânicos formados apenas por átomos de carbono e hidrogênio.
A imagem abaixo apresenta o alceno mais simples, formado por apenas dois átomos de carbono, nomeado como eteno.
Características dos alcenos
Uma característica marcante dos alcenos é a sua maior reatividade em relação aos alcanos. Isso se explica pela presença da dupla ligação, que torna a molécula mais suscetível a reagir com outras espécies.
Em razão da insaturação, os alcenos apresentam isomeria geométrica. A isomeria se refere ao arranjo espacial dos átomos em moléculas de mesma fórmula molecular.
No caso dos alcenos, a isomeria geométrica está relacionada ao arranjo espacial dos grupos ligantes unidos aos átomos de carbono da dupla ligação, podendo assumir as configurações cis e trans.
Para fazer essa análise, considera-se uma linha imaginária paralela à dupla ligação:
-
Configuração cis: os grupos ligantes iguais estão do mesmo lado da linha imaginária.
-
Configuração trans: os grupos ligantes iguais estão em lados opostos à linha.
Propriedades dos alcenos
A presença da ligação dupla nos alcenos altera algumas de suas propriedades físico-químicas, em comparação aos alcanos de mesmo número de átomos de carbono. Os alcenos podem existir nas fases sólida, líquida e gasosa, em temperatura ambiente.
Os isômeros cis dos alcenos possuem pontos de fusão e de ebulição mais baixos do que os alcenos em configuração trans. Isso se explica pela maior estabilidade das moléculas em posição trans.
A dupla ligação nos alcenos lhes confere um caráter apolar e, por isso, são insolúveis em água e solúveis em solventes orgânicos, como os álcoois, o benzeno e o éter.
A dupla ligação entre os átomos de carbono é constituída por uma ligação sigma (σ) e uma ligação pi (π), ambas de caráter covalente, isto é, formadas pelo compartilhamento de elétrons. A formação de uma ligação covalente ocorre quando um orbital incompleto (ocupado por um único elétron) de um átomo se sobrepõe ao orbital incompleto de outro átomo.
Essa sobreposição, ao ocorrer entre orbitais s ou p no mesmo eixo do núcleo dos átomos, dá origem à ligação sigma. Ao ocorrer entre orbitais p, de modo paralelo ao plano da molécula, isto é, acima e abaixo do eixo nuclear, formará a ligação pi.
Na imagem, a linha que une os dois átomos de carbono representa a formação da ligação σ. Já a região sombreada acima e abaixo da ligação σ é a região da ligação π. Os elétrons π podem se movimentar por toda a região sombreada e sentem menos a atração dos núcleos dos átomos de carbono. Ao contrário dos elétrons σ, que estão sob o controle dos núcleos atômicos de modo mais intenso. Por isso, as ligações σ são mais fortes e mais estáveis do que ligações π.
Devido a isso, as regiões de insaturação em uma molécula são mais suscetíveis a sofrer ataques de outras espécies químicas, atribuindo aos alcenos a característica de serem compostos de elevada reatividade.
As reações que ocorrem com os alcenos são centradas na insaturação. As reações de adição são bastante comuns, ocorrendo pela ruptura da ligação π que forma a ligação dupla, sendo os elétrons utilizados na formação de novas ligações químicas, agora com outros átomos.
→ Reações de adição
Veja uma representação para a reação de adição em alcenos, utilizando uma molécula geral AB:
As reações de adição aos alcenos recebem diferentes nomes, a depender da substância que será adicionada, podendo ser reações de hidrogenação, halogenação, hidratação ou ainda com haletos de hidrogênio.
O etanol pode ser formado por uma reação de hidratação, por meio da adição de água à molécula do eteno. Veja:
→ Reações de oxidação
Os alcenos também sofrem reações de oxidação, por meio do rompimento da dupla ligação e aumento do número de oxidação do carbono.
Na oxidação branda, o agente oxidante empregado é uma solução aquosa diluída de permanganato de potássio (KMnO4). Nessa reação, a dupla ligação é rompida para a formação de um diálcool (ou diol), ou seja, dois grupamentos hidroxila (-OH) se unem aos carbonos que formavam a ligação dupla.
Na oxidação enérgica, o meio reacional é mais agressivo, sendo empregada solução aquosa de permanganato de potássio ou dicromato de potássio (K2Cr2O7) em meio ácido ― normalmente com ácido sulfúrico (H2SO4) ― formando um agente oxidante potente. Nessa reação, a molécula do alceno é quebrada na ligação dupla, produzindo duas novas moléculas que podem cetonas, ácidos carboxílicos e/ou gás carbônico.
A natureza da molécula formada dependerá do tipo de carbono existente na dupla ligação.
-
Carbonos primários produzem CO2 e H2O.
-
Carbonos secundários formam ácido carboxílico.
-
Carbonos terciários formam cetonas.
Nomenclatura dos alcenos
A nomenclatura dos alcenos deve seguir as regras da Iupac (International Union of Pure and Applied Chemistry) para hidrocarbonetos. O nome da molécula é iniciado pelo prefixo, indicando o número de carbonos da cadeia principal, seguido do infixo, o qual indica a presença de insaturações ― para alcenos, será -en- ―, terminado pelo sufixo -o, indicando que se trata de um hidrocarboneto.
Observe a seguir a tabela associando os prefixos aos respectivos números de carbonos da molécula.
|
Número de carbonos |
Prefixo |
|
1 |
Met- |
|
2 |
Et- |
|
3 |
Prop- |
|
4 |
But- |
|
5 |
Pent- |
|
6 |
Hex- |
|
7 |
Hept- |
|
8 |
Oct- |
|
9 |
Non- |
|
10 |
Dec- |
Além disso, é necessário informar a localização da dupla ligação na cadeia carbônica do alceno. Para isso, é preciso:
-
identificar a cadeia principal como a sequência mais longa de carbonos que contenha a insaturação, numerando os átomos de carbono de modo a atribuir à insaturação o menor valor numérico possível;
-
informar a localização da insaturação pelo carbono de menor número.
Vejamos alguns exemplos:
Quando se tratar de alcenos dissubstituídos, em que cada átomo de carbono possui um grupo substituinte, deve-se usar a notação cis-trans para identificar o arranjo espacial dos substituintes. Vejamos exemplos.
Saiba mais: Nomenclatura dos alcanos — como é estabelecida?
Fórmula dos alcenos
A fórmula geral para os alcenos acíclicos (cadeia aberta) é CnH2n, sendo n o número de carbonos. Assim, conhecendo o número de carbonos em uma molécula, é possível determinar a quantidade de hidrogênios.
Quando n = 2, o número de hidrogênios é 4, e a fórmula molecular do alceno é C2H4.
Quando n = 3, o número de hidrogênios é 6, e a fórmula molecular do alceno é C3H6.
Quando n = 5, o número de hidrogênios é 10, e a fórmula molecular do alceno é C5H10.
Para alcenos cíclicos, isto é, de cadeia fechada, a fórmula geral é CnH2n-2. Nesse caso, quando n = 5, o número de hidrogênios é 8, e a fórmula molecular do alceno é C5H8.
Fontes de obtenção dos alcenos
Os alcenos formados por até cinco átomos de carbono podem ser obtidos por meio do refino do petróleo, e aqueles de cadeia maior normalmente são preparados em laboratório. Desse modo, algumas das formas mais comuns de preparação dos alcenos em laboratório podem ser observadas a seguir.
→ Craqueamento de alcanos
Alcenos podem ser formados como produto da reação de craqueamento de alcanos. Nessa reação, ligações entre carbonos são quebradas, formando alcanos e alcenos de menor cadeia. O processo ocorre mediante aquecimento e uso de catalisadores.
Esse processo é empregado para se obter a mistura de hidrocarbonetos que formam a gasolina, por meio de moléculas de maior cadeia carbônica.
→ Desidratação de álcoois
Alcenos podem ser preparados por meio de um álcool, com uma reação de desidratação intermolecular que ocorre com presença de ácido sulfúrico e calor. Nesse processo, a molécula de álcool elimina uma molécula de água, e uma ligação dupla é formada entre carbonos. A temperatura do meio reacional interfere no produto formado. A formação de alcenos é priorizada em cerca de 180 °C.
→ Hidrogenação de alcinos
Alcinos são hidrocarbonetos com ligação tripla entre carbonos. Essas espécies reagem com o gás hidrogênio (H2) quando na presença de catalisadores, como ouro, platina ou paládio.
A reação se dá pela interação do alcino com a superfície do catalisador, de modo que as ligações π ficam enfraquecidas e favorecem a interação dos elétrons π com o H2. Assim, formam-se novas ligações entre carbono e hidrogênio. A tripla ligação agora se torna uma dupla ligação, originando o alceno.
Aplicações dos alcenos
O eteno (C2H4) é o alceno mais utilizado no setor industrial e é também denominado etileno. O etileno é produzido naturalmente por vegetais, sendo o agente responsável pelo amadurecimento das frutas, muito usado na indústria de alimentos.
Para facilitar o transporte e evitar perdas, normalmente as frutas são colhidas ainda verdes e armazenadas sob refrigeração até o momento de distribuição para o comerciante final. Nesse momento, as frutas são transferidas para ambientes com gás etileno, que então promoverá o amadurecimento mais rapidamente.
Em casa, também é possível utilizar uma técnica similar para amadurecer aquelas frutas compradas muito verdes: basta armazená-las em um ambiente fechado, como um recipiente plástico ou envoltas em papel de jornal. Isso forma uma espécie de estufa e não deixa o gás etileno se difundir na atmosfera.
Nos vegetais, o etileno possui muitas outras funções, associadas à germinação, indução de flores, crescimento do caule, formato das folhas, entre outras.
O etileno também faz parte da composição de alguns agentes anestésicos e é o material de partida para o polietileno, um tipo de plástico utilizado extensivamente no mundo moderno, usado na confecção de embalagens plásticas, sacolas, brinquedos e objetos.
O polietileno é um polímero formado pela reação de adição de inúmeras moléculas de eteno, as quais têm a ligação dupla rompida para constituir novas ligações com átomos de carbono, originando longas cadeias carbônicas.
O estireno é outro alceno que dá origem ao poliestireno, um material polimérico de caráter duro e quebradiço. Ainda, alcenos também são usados na composição de substâncias anticongelantes e de solventes orgânicos. Também compõem fibras sintéticas, borrachas e corantes.
Saiba também: Como se formam os polímeros?
Exercícios resolvidos sobre alcenos
Questão 1
(Ufla 2009) A presença de ligações carbono-carbono duplas ou triplas nos hidrocarbonetos aumenta consideravelmente a reatividade química deles. As reações mais características de alcenos e alcinos são as reações de adição. A adição de HCl ao composto X forma o 2-cloropropano. Qual é o composto X?
A) propano
B) propino
C) ciclopropano
D) propeno
Resolução:
Alternativa D
Questão 2
(Mackenzie) Os alcenos podem sofrer reações de oxidação branda ou enérgica, dependendo das condições do meio reacional. A oxidação branda ocorre em presença de um agente oxidante, geralmente KMnO4, em solução aquosa diluída, neutra ou levemente alcalina, e leva à formação de um diol. Já a oxidação enérgica do alceno ocorre em presença de uma solução concentrada do agente oxidante, aquecida e ácida, e leva à formação de ácidos carboxílicos e/ou cetonas. Ciente dessas informações, um técnico químico realizou uma reação de oxidação enérgica para duas amostras de diferentes alcenos, A e B, e obteve os seguintes resultados:
De acordo com as informações acima, os alcenos A e B são, respectivamente:
A) eteno e 2-metil-pent-1-eno.
B) but-1-eno e hex-2-eno.
C) eteno e pent-2-eno.
D) but-2-eno e 2-metil-hex-2-eno.
E) but-2-eno e 2-metil-pent-2-eno.
Resolução:
Alternativa E
A natureza de produto formado na reação de oxidação enérgica de alcenos depende do tipo de carbono (primário, secundário ou terciário) que formava a dupla ligação:
-
Carbonos primários produzem CO2 e H2O.
-
Carbonos secundários formam ácido carboxílico.
-
Carbonos terciários formam cetonas.
A oxidação do alceno A formou ácido acético. O ácido acético (CH3COOH) é um ácido carboxílico, logo, o alceno A possuía carbonos secundários.
A oxidação do alceno B formou uma cetona (acetona = propanona) e ácido carboxílico (ácido propanoico). Logo, os carbonos da insaturação do alceno B eram terciários e secundários, respectivamente.



